题目内容
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
A.200℃时,反应从开始到平衡的平均速率v(B)=" 0." 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
AD
解析试题分析:A、200℃时,反应从开始到平衡,B物质的量变化为0.2mol,浓度变化为0.1mol/L,反应速率为0.02 mol·L-1·min-1,正确;B、由图I可知x、y、z比为2:1:1,由图II可知温度越高,C的体积分数越大,说明正反应是吸热反应,且a=2,错误;C、定温定容条件下向平衡后的体系中充入氦气,各组分浓度不变,反应速率不变,平衡不移动,正、逆反应速率相等,错误;D、由图I可知容器中充入0.8molA、0.4molB,平衡时A的体积分数为0.5;若起始时充入2molA、1molB,浓度加倍等效于增大压强,平衡向右移动,A的体积分数小于0.5,正确。
考点: 化学反应速率 勒沙特列原理 等效平衡

已知反应mX(g)+nY(g) qZ(g)+pW(s)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法一定正确的是
qZ(g)+pW(s)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法一定正确的是
| A.通入氦气使密闭容器中压强增大,平衡向正反应方向移动 |
| B.增加X的物质的量,混合气体的密度减小 |
| C.降低温度,混合气体的平均相对分子质量增大 |
| D.X的正反应速率是Y的逆反应速率的m/n倍 |
有关下列图像的说法正确的是
| A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 |
| B.根据图②判断,物质A反应生成物质C的△H>0 |
| C.曲线图③可表示向一定量的硫酸溶液中滴加一定浓度氢氧化钠溶液时的pH变化 |
| D.开关K置于A或B处均可减缓铁的腐蚀 |
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是
CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是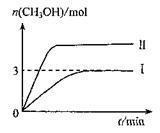
| A.曲线II对应的条件改变是增大压强 |
| B.T2°C时,上述反应平衡常数为0.42,则T2> T1 |
| C.在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆) |
D.在T10C,若起始时向容器由通入4,5 molCO2、6mol H2 ,平衡时容器内压强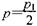 |
向甲、乙、丙三个密闭容器中充人一定量的A和B,发生反应:xA(g)+B(g) 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示 ( )
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1. 0L |
| 温度/ | T1 | T2 | T3 |
| 反应物 起始量 | 0.5molA 1.5 molB | 0.5 molA 1.5 molB | 2.0 molA 6.0 molB |
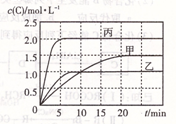
下列说法正确的是
A.由图可知:T1<T2,且该反应为吸热反应
B.T2时该反应的平衡常数K=0.8
C.l0min内甲容器中反应的平均速率v(B)=0.025mol·(L·min)-1
D.T1℃,若起始时甲容器中充入1.5molA、0.5molB,平衡时B的转化率为25%
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)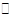 4NO2 +O2(g)△H>0,T1温度下的部分实验数据为:
4NO2 +O2(g)△H>0,T1温度下的部分实验数据为:
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.55 | 2.50 | 2.50 |
下列说法中,正确的是:
A.当反应体系内气体的平均相对分子质量不再发生变化时则该反应达到了平衡
B.T1温度下的平衡常数为K1=125,500s时N2O5的转化率为71%:
C.其他条件不变时,T2温度下反应到2000s时测得N2O5 (g)浓度为2.78mol/L, 则T1<T2
D.T1温度下的平衡常数为K1,若维持T1温度不变,增加体系压强,达到新的平衡时,平衡常数为K2,则K2>K1
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是
CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是
| A.该反应的△H<0 |
| B.其他条件不变,升高温度反应的平衡常数增大 |
C.300℃时,0–t1 min内CH3OH的平均生成速率为 mol?L-1 min-1 mol?L-1 min-1 |
D.A点的反应体系从300℃升高到500℃,达到平衡时 减小 减小 |
关于下列四个说法正确的是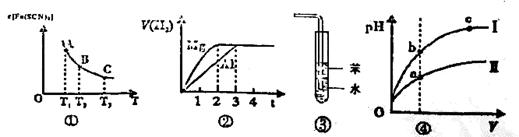
| A.已知图①是体系Fe3++3SCN-=Fe(SCN)3中c[Fe(SCN)3]与温度T的平衡图像,则A点与B点相比,A点的Fe3+浓度大 |
| B.图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V(H2) 与时间t的关系。则反应中镁和铝的反应速率之比为2 : 3 |
| C.图③可用于吸收HCl气体,并防倒吸 |
| D.图④是某温度下,相同体积,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线。II为醋酸稀释时pH的变化曲线 |
 2HBr(g) (正反应放热),平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。 a与b的关系是
2HBr(g) (正反应放热),平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。 a与b的关系是