题目内容
已知反应A(g)+3B(g)  2C(g)+D(g),在某段时间内,以A的浓度变化表示的反应速率为2 mol/(L·s),则以C的浓度变化表示的反应速率为
2C(g)+D(g),在某段时间内,以A的浓度变化表示的反应速率为2 mol/(L·s),则以C的浓度变化表示的反应速率为
| A.1 mol/(L·s) | B.3 mol/(L·s) |
| C.4 tool/(L·s) | D.2 mol/(L·s) |
C
解析试题分析:因为反应速率之比是相应的化学计量数之比,所以根据反应的化学方程式可知,如果以A的浓度变化表示的反应速率为2 mol/(L·s),则以C的浓度变化表示的反应速率为2 mol/(L·s)×2=4 mol/(L·s),答案选C。
考点:考查反应速率的计算
点评:该题是高考中的常见考点,属于常识性计算题的考查,难度不大。明确反应速率和化学计量数的关系是答题的关键,有利于培养学生的逻辑思维能力和规范答题能力。

练习册系列答案
相关题目
有关下列图像的说法正确的是
| A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 |
| B.根据图②判断,物质A反应生成物质C的△H>0 |
| C.曲线图③可表示向一定量的硫酸溶液中滴加一定浓度氢氧化钠溶液时的pH变化 |
| D.开关K置于A或B处均可减缓铁的腐蚀 |
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是
CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是
| A.该反应的△H<0 |
| B.其他条件不变,升高温度反应的平衡常数增大 |
C.300℃时,0–t1 min内CH3OH的平均生成速率为 mol?L-1 min-1 mol?L-1 min-1 |
D.A点的反应体系从300℃升高到500℃,达到平衡时 减小 减小 |
关于下列四个说法正确的是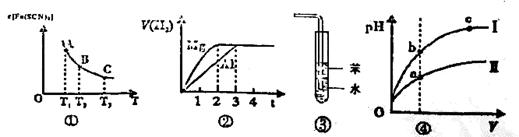
| A.已知图①是体系Fe3++3SCN-=Fe(SCN)3中c[Fe(SCN)3]与温度T的平衡图像,则A点与B点相比,A点的Fe3+浓度大 |
| B.图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V(H2) 与时间t的关系。则反应中镁和铝的反应速率之比为2 : 3 |
| C.图③可用于吸收HCl气体,并防倒吸 |
| D.图④是某温度下,相同体积,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线。II为醋酸稀释时pH的变化曲线 |
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,甲醇物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是( )
CH3OH(g) ,其他条件不变,在300℃和500℃时,甲醇物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是( )
| A.该反应的△H>0 |
| B.其他条件不变,升高温度反应的平衡常数增大 |
C.300℃时,0-t 1min内 CH3OH的平均生成速率为 mol·L-1 min-1 mol·L-1 min-1 |
D.A点的反应体系从300℃升高到500℃,达到平衡时 减小 减小 |
在25℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图: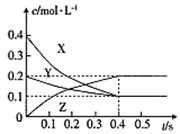
下列说法错误的是( )
A.反应可表示为3X+Y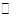 2Z 2Z |
| B.从反应开始到0.4s时,以Y表示的化学反应速率为:0.25mol·L-1·s-1 |
| C.增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D.升高温度,平衡常数可能增大也可能减小 |
下列措施中,能减慢化学反应速率的是
| A.食物储存在冰箱里 |
| B.将块状固体药品研细后再反应 |
| C.用MnO2作H2O2分解反应的催化剂 |
| D.用30%H2SO4溶液代替5%H2SO4溶液与锌粒反应 |
 2HBr(g) (正反应放热),平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。 a与b的关系是
2HBr(g) (正反应放热),平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。 a与b的关系是  2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于( )
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于( )