题目内容
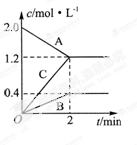
反应:N2(g)+3H2(g) 2NH3(g) △H<0。在等容条件下进行。体系中各物质浓度随时间变化的曲线如图所示,回答问题:
2NH3(g) △H<0。在等容条件下进行。体系中各物质浓度随时间变化的曲线如图所示,回答问题:
(1)图中B为 (填“N2”、“H2”或“NH3”)计算反应从开始→达平衡时H2的反应速率v(H2)=
(2)下图是在某温度下反应达到平衡,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示体系中各物质的浓度随时间变化的趋势(不需计算新平衡时的具体浓度,只要新平衡时浓度处于一个合理范围内即可。曲线上必须标出N2、H2、NH3)。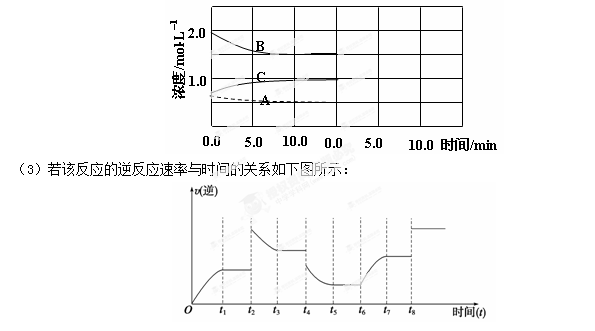
反应在t1、t3、t5、t7时都达到了平衡,而t2、t4、t6、t8时都改变了条件,试判断改变的条件是(填“升温”、“降压”……?等);t2时 ;t6时 ;t4时,平衡向 (填“正”或“逆”)反应方向移动。

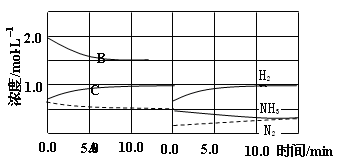
(3)升温(2分);增大N2或H2浓度(2分) 逆(2分)
解析试题分析:由图可知,B达到平衡时消耗了3mol/L,而A消耗了1mol/L,C生成了3mol/L,再由化学反应的系数可知A为氮气,B为氢气,C为氨气。而反应速率等于反应物浓度的变化量除以浓度变化所需的时间,因此氢气的反应速率为3除以20等于0.02摩尔每升每分。在达到新平衡时,氮气的浓度范围为0.25至0.5摩尔每升,氢气浓度范围为0.75至1.5摩尔每升。氨气的浓度范围为0至0.25摩尔每升。升高温度,反应速率增大,平衡向吸热的方向进行,。增大反应物浓度,正反应速率增大
考点:考查化学反应速率与化学平衡的相关知识点

 名校课堂系列答案
名校课堂系列答案将H2(g)和Br2(g)充入恒容密闭容器中,恒温下发生反应H2(g)+Br2(g)  2HBr(g) (正反应放热),平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。 a与b的关系是
2HBr(g) (正反应放热),平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。 a与b的关系是
| A.a>b | B.a =b | C.a <b | D.无法确定 |
X、Y、Z三种气体,取X和Y按1︰1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于( )
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于( )
| A.33% | B.40% | C.50% | D.66% |
100mL 6 mol / L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
| A.硫酸钾溶液 | B.醋酸 | C.氯化钠(固体) | D.盐酸 |
在

 的可逆反应中,自反应开始至2 s末,氨的浓度由0变为0.4
的可逆反应中,自反应开始至2 s末,氨的浓度由0变为0.4 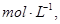 则以氢气的浓度变化表示该反应在2 s内的平均反应速率是
则以氢气的浓度变化表示该反应在2 s内的平均反应速率是
A.0.3 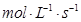 | B.0.4 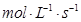 |
C.0.6 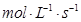 | D.0.8 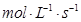 |
(6分)某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验。结果如下表:
| 实验 序号 | 铁的质量/g | 铁的 形态 | V(H2SO4) /mL | c(H2SO4) /mol·L-1 | 反应前溶液 的温度/℃ | 金属完全消 失的时间/s |
| 1 | 0.10 | 片状 | 50 | 0.8 | 20 | 200 |
| 2 | 0.10 | 粉状 | 50 | 0.8 | 20 | 25 |
| 3 | 0.10 | 片状 | 50 | 1.0 | 20 | 125 |
| 4 | 0.10 | 片状 | 50 | 1.0 | 35 | 50 |
(1)实验1、2 表明 对反应速率有影响。
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号)。
(3)该探究实验中,影响反应速率的因素还有 ,体现该影响因素的实验有 (填实验序号)。
(4)进行实验3时,若将稀硫酸改为50 mL 2.0 mol·L-1 盐酸(其他条件不变),发现:放出气泡的速率,盐酸明显比硫酸快。你认为可能的原因是 。(忽略温度对反应速率的影响)
 NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
NaNO3(s)+ClNO(g) K1 ?H < 0 (I)