题目内容
将4 mol A气体和2mol B气体在2 L的密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g) 2C(g),反应2 s后测得C的物质的量为1.2mol。下列说法正确的是( )
2C(g),反应2 s后测得C的物质的量为1.2mol。下列说法正确的是( )
| A.用物质B表示2s内的平均反应速率为0.6 mol/(L·s) |
| B.用物质A表示2 s内的平均反应速率为0.3 mol/(L·s) |
| C.2 s后物质A的转化率为70% |
| D.2 s后物质B的浓度为0.35 mol/L |
B
解析试题分析: 2A(g)+B(g) 2C(g)
2C(g)
起始浓度(mol/L) 2 1 0
转化浓度(mol/L) 0.6 0.3 0.6
2s后浓度(mol/L) 1.4 0.7 0.6
则用物质B表示2s内的平均反应速率为0.3mol/L÷2s=0.15 mol/(L·s),A不正确;
用物质A表示2s内的平均反应速率为0.6mol/L÷2s=0.3mol/(L·s),B正确;
2s后物质A的转化率为 ,C不正确;
,C不正确;
2s后物质B的浓度为0.7mol/L,D不正确,答案选B。
考点:考查可逆反应的有关计算
点评:在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某时刻的量,然后依据已知条件列式计算即可,有利于培养学生的规范答题能力。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案关于下列四个说法正确的是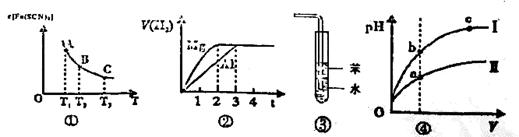
| A.已知图①是体系Fe3++3SCN-=Fe(SCN)3中c[Fe(SCN)3]与温度T的平衡图像,则A点与B点相比,A点的Fe3+浓度大 |
| B.图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V(H2) 与时间t的关系。则反应中镁和铝的反应速率之比为2 : 3 |
| C.图③可用于吸收HCl气体,并防倒吸 |
| D.图④是某温度下,相同体积,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线。II为醋酸稀释时pH的变化曲线 |
将H2(g)和Br2(g)充入恒容密闭容器中,恒温下发生反应H2(g)+Br2(g)  2HBr(g) (正反应放热),平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。 a与b的关系是
2HBr(g) (正反应放热),平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。 a与b的关系是
| A.a>b | B.a =b | C.a <b | D.无法确定 |
COCl2(g)  CO(g)+Cl2(g);ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g);ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
| A.①②④ | B.①④⑥ |
| C.②③⑤ | D.③⑤⑥ |
为探究足量锌与稀硫酸的反应速率(以v(H2)表示),向反应混合液中加入某些物质,下列判断正确的是( )
| A.加入NH4HSO4固体,v(H2)不变,生成H2量不变 |
| B.加入少量水,v(H2)减小,生成H2量减少 |
| C.加入CH3COONa固体,v(H2)减小,生成H2量不变 |
| D.滴加少量CuSO4溶液,v(H2)增大,生成H2量减少 |
X、Y、Z三种气体,取X和Y按1︰1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于( )
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于( )
| A.33% | B.40% | C.50% | D.66% |
100mL 6 mol / L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
| A.硫酸钾溶液 | B.醋酸 | C.氯化钠(固体) | D.盐酸 |
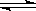 3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是
3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是