题目内容
16.反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在2.0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了9.0mol,则此反应的平均速率v(x)(反应物的消耗速率或产物的生成速率)可表示为( )| A. | v(NH3)=0.010mol/(L•s) | B. | v(O2)=0.10mo1/(L•s) | ||
| C. | v(NO)=0.10mo1/(L•s) | D. | v(H2O)=0.30mol/(L•s) |
分析 根据v=$\frac{△c}{△t}$计算v(H2O),再利用速率之比等于其化学计量数之比计算其它物质表示的速率.
解答 解:2.0L密闭容器中进行,半分钟后水蒸气的物质的量增加了9.0mol,则v(H2O)=$\frac{\frac{9mol}{2L}}{30s}$=0.15mo1/(L•s),速率之比等于其化学计量数之比,则:
v(NH3)=$\frac{2}{3}$v(H2O)=$\frac{2}{3}$×0.15mo1/(L•s)=0.1mol/(L•s),
v(O2)=$\frac{5}{6}$v(H2O)=$\frac{5}{6}$×0.15mo1/(L•s)=0.125mol/(L•s),
v(NO)=$\frac{2}{3}$v(H2O)=$\frac{2}{3}$×0.15mo1/(L•s)=0.1mol/(L•s),
由上述计算,可知ABD错误,C正确,故选C.
点评 本题考查化学反应速率有关计算,难度不大,常用方法有定义法与速率规律比值法.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
6.下列实验完毕后,一定能出现白色浑浊现象的是( )
| A. | 浓苯酚溶液中滴加少量稀溴水 | B. | NaAlO2溶液滴入过量苯酚溶液 | ||
| C. | 稀苯酚钠溶液中通入少量CO2 | D. | AgNO3溶液中滴入过量氨水 |
7.下列说法或表示方法正确的是( )
| A. | 2A(l)+B(l)=2C(l)△H1 2A (g)+B(g)=2C(l)△H2 则△H1>△H2 | |
| B. | 31g红磷变成31g白磷要吸收能量,说明红磷比白磷更稳定 | |
| C. | 测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH的起始温度和反应结束后稳定的温度 | |
| D. | 在101 kPa时,已知氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ/mol |
4.对于铜锌原电池实验后得出的结论和认识中,正确的是( )
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌电极与硫酸铜溶液组成的原电池中铜是负极 | |
| C. | 电子由锌片流经稀硫酸溶液到铜片,氢离子在铜片上得到电子放出氢气 | |
| D. | 铜锌原电池工作时,若有13g锌被溶解,电路中就有0.4mol电子通过 |
8.下列有关化学用语表述不正确的是( )
| A. | 氨气分子的电子式: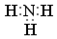 | B. | CO2分子的结构式:O=C=O | ||
| C. | S2-的结构示意图: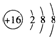 | D. | CH4的分子模型示意图为: |
5.设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1L 0.1mol/L的醋酸溶液含有0.1nA个H+ | |
| B. | 1molSiO2与足量的焦炭高温下完全反应生成硅,转移4nA个电子 | |
| C. | 标准状况下,11.2L H2O含有共价键的数目为nA | |
| D. | 常温常压下,14 g 由N2与C2H4组成的混合气体含有的原子数目为nA |
6.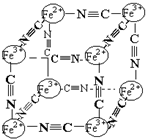 分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )
 分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )| A. | 该晶体是原子晶体 | |
| B. | M的离子位于上述立方体的面心,呈+2价 | |
| C. | M的离子位于上述立方体的体心,呈+1价,且M+空缺率(体心中没有M+的占总体心的百分比)为50% | |
| D. | 晶体的化学式可表示为MFe2(CN)3,且M为+1价 |

 .
.