题目内容
1.硫通常是一种淡黄色晶体.有橙色、无色、红棕色三种颜色的硫蒸气,它们都是硫的单质,但每个分子中硫原子的个数不同,可用Sx表示.对三种蒸气测定结果是:橙色蒸气密度折算到标准状况后是11.43g/L,则它的化学式是S8.无色蒸气对氢气的相对密度是64,则它的化学式是S4.此事实说明硫单质有同素异形现象.分析 根据M=ρVm计算该SX蒸气的摩尔质量,据此计算x值,写出化学式;相同条件下,密度之比等于等于摩尔质量之比,据此计算SX蒸气的摩尔质量,计算x值,写出化学式;由同种元素组成的不同单质叫同素异形体,据此判断.
解答 解:标准状况密度为11.34克/升,则SX蒸气的摩尔质量为M=ρ×Vm=11.34g/L×22.4L/mol=254g/mol,所以32x=254,解得,x=8,所以为S8,
相同条件下,密度之比等于等于摩尔质量之比,所以SX蒸气的摩尔质量为2g/mol×64=128g/mol,所以32x=128,解得x=4,所以为S4,
S8、S4是由硫元素组成的单质,此事实说明硫单质有同素异形现象,
故答案为:S8;S4;同素异形.
点评 本题考查了摩尔质量、相对分子量的计算,题目难度不大,注意摩尔质量与相对分子量的关系,该题是高考中的常见题型,旨在培养学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
11.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,40 g SO3所含的氧原子的数目为1.5 NA | |
| B. | 5.6 g铁与足量氯气或硫蒸气反应转移的电子数均为0.3 NA | |
| C. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA | |
| D. | 常温下5.6 g铁投入到足量浓硝酸中反应,转移电子数为0.3 NA |
12.四种常见元素的相关信息如下表所示,请回答下列问题:
(1)W的基态原子的价电子排布式为4s24p3,Z、W两种元素的第一电离能的大小关系为Cl>As(用元素符号表示).
(2)Z能与X、Y、W形成XZ4、YZ3、WZ3、WZ5等化合物,其中中心原子杂化方式为sp3的分子是CCl4、NCl3、AsCl3(填化学式,下同),分子构型为正四面体的是CCl4.
(3)Y、Z及氢、铂元素可组成为Pt(YH3)2Z2的配合物,该配合物存在两种不同的结构:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大.
①Q是非极性分子(填“极性”或“非极性”).
②P分子的结构简式为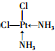 (YH3作为一个整体写)
(YH3作为一个整体写)
(4)X的一种单质分子(N)的球棍模型如图1所示,该分子中每个X原子均形成了稳定的8电子结构,则分子中σ键与π键数目之比为3:1.一定条件下含NA个X原子的N与足量氢气发生加成反应时,消耗1gH2
(5)W与镓的化合物(GaW)是一种半导体材料,其晶胞结构如图2所示,镓原子的配位数是4,该晶胞的密度为ρg•cm-3,则该晶胞的边长为$\root{3}{\frac{580}{ρ•{N}_{A}}}$cm(用含NA、ρ的代数式表示).
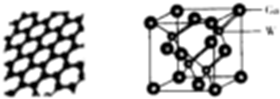
图1 图2.
| 元素 | X | Y | Z | W |
| 相关信息 | 短周期p区元素,有种单质常作电极材料 | 基态原子2p能级上各轨道中均有电子且电子的自旋方向相同 | 基态原子的核外电子共有17种运动状态 | 位于第四周期第VA族 |
(2)Z能与X、Y、W形成XZ4、YZ3、WZ3、WZ5等化合物,其中中心原子杂化方式为sp3的分子是CCl4、NCl3、AsCl3(填化学式,下同),分子构型为正四面体的是CCl4.
(3)Y、Z及氢、铂元素可组成为Pt(YH3)2Z2的配合物,该配合物存在两种不同的结构:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大.
①Q是非极性分子(填“极性”或“非极性”).
②P分子的结构简式为
 (YH3作为一个整体写)
(YH3作为一个整体写)(4)X的一种单质分子(N)的球棍模型如图1所示,该分子中每个X原子均形成了稳定的8电子结构,则分子中σ键与π键数目之比为3:1.一定条件下含NA个X原子的N与足量氢气发生加成反应时,消耗1gH2
(5)W与镓的化合物(GaW)是一种半导体材料,其晶胞结构如图2所示,镓原子的配位数是4,该晶胞的密度为ρg•cm-3,则该晶胞的边长为$\root{3}{\frac{580}{ρ•{N}_{A}}}$cm(用含NA、ρ的代数式表示).

图1 图2.
16.反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在2.0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了9.0mol,则此反应的平均速率v(x)(反应物的消耗速率或产物的生成速率)可表示为( )
| A. | v(NH3)=0.010mol/(L•s) | B. | v(O2)=0.10mo1/(L•s) | ||
| C. | v(NO)=0.10mo1/(L•s) | D. | v(H2O)=0.30mol/(L•s) |
10.下列能用H++OH-=H2O表示的是( )
| A. | 稀硫酸和氢氧化钡溶液反应 | B. | 稀硝酸与氢氧化钠溶液反应 | ||
| C. | 醋酸与氢氧化钾溶液反应 | D. | 盐酸与氢氧化铁反应 |
11.化学与生产、生活密切相关.下列说法正确的是( )
| A. | 石英可导电,用于生产光导纤维 | |
| B. | 常见的氮肥都属于铵盐类无机物 | |
| C. | 粗盐经过溶解、过滤、蒸发结晶,即可得到纯净物氯化钠 | |
| D. | 生活中食用的食醋、植物油、动物蛋白等物质都是混合物 |
 .
. ,
, .
.