题目内容
4.对于铜锌原电池实验后得出的结论和认识中,正确的是( )| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌电极与硫酸铜溶液组成的原电池中铜是负极 | |
| C. | 电子由锌片流经稀硫酸溶液到铜片,氢离子在铜片上得到电子放出氢气 | |
| D. | 铜锌原电池工作时,若有13g锌被溶解,电路中就有0.4mol电子通过 |
分析 A、构成原电池正极和负极的材料只要是活泼性不同即可;
B、由铜、锌电极与硫酸铜溶液组成的原电池中,失电子的是锌;
C、由铜、锌电极与硫酸铜溶液组成的原电池中,氢离子在铜片上得到电子放出氢气;
D、铜锌原电池工作时,负极上发生反应Zn-2e-=Zn2+,据此计算.
解答 解:A、构成原电池正极和负极的材料不一定是两种金属,也可以是一种金属和一种非金属,故A错误;
B、由铜、锌电极与硫酸铜溶液组成的原电池中失电子的是锌,所以锌是负极,故B错误;
C、电子由锌片流经导线而不是经稀硫酸溶液到铜片,氢离子在铜片上得到电子放出氢气,故C错误;
D、铜锌原电池工作时,负极上发生反应Zn-2e-=Zn2+,若有13g锌即0.2mol锌被溶解,电路中就有0.4mol电子通过,故D正确;
故选D.
点评 本题涉及原电池正负极的选择和判断,原电池的简单计算等知识,属于综合中知识的考查,难度不大.

练习册系列答案
相关题目
14.LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车.电池反为:FePO4+Li═LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质.下列有关LiFePO4电池说法正确的是( )
| A. | 可加入硫酸以提高电解质的导电性 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 充电过程中,电池正极材料的质量增加 | |
| D. | 放电时电池正极反应为:FePO4+Li++e-═LiFePO4 |
12.四种常见元素的相关信息如下表所示,请回答下列问题:
(1)W的基态原子的价电子排布式为4s24p3,Z、W两种元素的第一电离能的大小关系为Cl>As(用元素符号表示).
(2)Z能与X、Y、W形成XZ4、YZ3、WZ3、WZ5等化合物,其中中心原子杂化方式为sp3的分子是CCl4、NCl3、AsCl3(填化学式,下同),分子构型为正四面体的是CCl4.
(3)Y、Z及氢、铂元素可组成为Pt(YH3)2Z2的配合物,该配合物存在两种不同的结构:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大.
①Q是非极性分子(填“极性”或“非极性”).
②P分子的结构简式为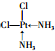 (YH3作为一个整体写)
(YH3作为一个整体写)
(4)X的一种单质分子(N)的球棍模型如图1所示,该分子中每个X原子均形成了稳定的8电子结构,则分子中σ键与π键数目之比为3:1.一定条件下含NA个X原子的N与足量氢气发生加成反应时,消耗1gH2
(5)W与镓的化合物(GaW)是一种半导体材料,其晶胞结构如图2所示,镓原子的配位数是4,该晶胞的密度为ρg•cm-3,则该晶胞的边长为$\root{3}{\frac{580}{ρ•{N}_{A}}}$cm(用含NA、ρ的代数式表示).

图1 图2.
| 元素 | X | Y | Z | W |
| 相关信息 | 短周期p区元素,有种单质常作电极材料 | 基态原子2p能级上各轨道中均有电子且电子的自旋方向相同 | 基态原子的核外电子共有17种运动状态 | 位于第四周期第VA族 |
(2)Z能与X、Y、W形成XZ4、YZ3、WZ3、WZ5等化合物,其中中心原子杂化方式为sp3的分子是CCl4、NCl3、AsCl3(填化学式,下同),分子构型为正四面体的是CCl4.
(3)Y、Z及氢、铂元素可组成为Pt(YH3)2Z2的配合物,该配合物存在两种不同的结构:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大.
①Q是非极性分子(填“极性”或“非极性”).
②P分子的结构简式为
 (YH3作为一个整体写)
(YH3作为一个整体写)(4)X的一种单质分子(N)的球棍模型如图1所示,该分子中每个X原子均形成了稳定的8电子结构,则分子中σ键与π键数目之比为3:1.一定条件下含NA个X原子的N与足量氢气发生加成反应时,消耗1gH2
(5)W与镓的化合物(GaW)是一种半导体材料,其晶胞结构如图2所示,镓原子的配位数是4,该晶胞的密度为ρg•cm-3,则该晶胞的边长为$\root{3}{\frac{580}{ρ•{N}_{A}}}$cm(用含NA、ρ的代数式表示).

图1 图2.
19.金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称.下列有关${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti的说法中正确的是( )
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti原子中均含有22个中子 | |
| B. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti质子数相同 | |
| C. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti质量数不同,不能互称同位素 | |
| D. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti化学性质不同 |
16.反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在2.0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了9.0mol,则此反应的平均速率v(x)(反应物的消耗速率或产物的生成速率)可表示为( )
| A. | v(NH3)=0.010mol/(L•s) | B. | v(O2)=0.10mo1/(L•s) | ||
| C. | v(NO)=0.10mo1/(L•s) | D. | v(H2O)=0.30mol/(L•s) |
 .
. .
. A、B、C、D是由短周期元素形成的单质.B、E均为组成空气的成分.化合物F的焰色反应呈黄色.在G中,非金属元素与金属元素的原子个数比为1:2.在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):
A、B、C、D是由短周期元素形成的单质.B、E均为组成空气的成分.化合物F的焰色反应呈黄色.在G中,非金属元素与金属元素的原子个数比为1:2.在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出): .
.