题目内容
5.设nA为阿伏伽德罗常数的数值,下列说法正确的是( )| A. | 1L 0.1mol/L的醋酸溶液含有0.1nA个H+ | |
| B. | 1molSiO2与足量的焦炭高温下完全反应生成硅,转移4nA个电子 | |
| C. | 标准状况下,11.2L H2O含有共价键的数目为nA | |
| D. | 常温常压下,14 g 由N2与C2H4组成的混合气体含有的原子数目为nA |
分析 A、醋酸是弱电解质,不能完全电离;
B、SiO2与足量的焦炭反应后硅元素的价态变为0价;
C、标况下,水为液态;
D、N2与C2H4的摩尔质量均为28g/mol,但氮气是双原子分子,而乙烯是6原子分子.
解答 解:A、醋酸是弱电解质,不能完全电离,故溶液中的氢离子的个数小于0.1nA个,故A错误;
B、SiO2与足量的焦炭反应后硅元素的价态变为0价,故1molSiO2转移4mol电子,故B正确;
C、标况下,水为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、N2与C2H4的摩尔质量均为28g/mol,则14g混合气体的物质的量n=$\frac{14g}{28g/mol}$=0.5mol,但由于氮气是双原子分子,而乙烯是6原子分子,故0.5mol混合气体中的原子的物质的量介于1mol-3mol,即原子个数介于NA-3NA之间,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意的是弱电解质不能完全电离.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在2.0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了9.0mol,则此反应的平均速率v(x)(反应物的消耗速率或产物的生成速率)可表示为( )
| A. | v(NH3)=0.010mol/(L•s) | B. | v(O2)=0.10mo1/(L•s) | ||
| C. | v(NO)=0.10mo1/(L•s) | D. | v(H2O)=0.30mol/(L•s) |
20.下列物质中,不能发生消去反应的是( )
①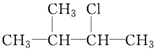 ②CH2Br2 ③
②CH2Br2 ③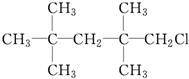 ④CH2═CHBr.
④CH2═CHBr.
①
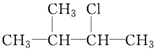 ②CH2Br2 ③
②CH2Br2 ③ ④CH2═CHBr.
④CH2═CHBr.| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
10.下列能用H++OH-=H2O表示的是( )
| A. | 稀硫酸和氢氧化钡溶液反应 | B. | 稀硝酸与氢氧化钠溶液反应 | ||
| C. | 醋酸与氢氧化钾溶液反应 | D. | 盐酸与氢氧化铁反应 |
17.下列实验装置正确且能完成实验目的是( )
| A. | 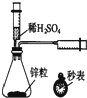 测定一定时间内生成H2的反应速率 | B. | 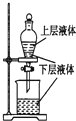 提取海带中的碘 | ||
| C. |  检验火柴燃烧产生的SO2 | D. | 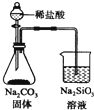 证明非金属性:Cl>C>Si |
15.如表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(3)小题用元素符号或化学式回答,(4)~(6)小题按题目要求回答.
(1)最高价氧化物的水化物碱性最强的物质是Mg(OH)2,呈两性的物质是Al(OH)3.
(2)A分别与D、E、F、G、H形成的化合物中,最稳定的物质是HF
(3)在B、C、E、F、G、H中,原子半径最大的是Mg
(4)A和E组成的最简单化合物的结构式
(5)用电子式表示B和H组成化合物的形成过程
(6)H的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式6H++Al2O3=2Al3++3H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)A分别与D、E、F、G、H形成的化合物中,最稳定的物质是HF
(3)在B、C、E、F、G、H中,原子半径最大的是Mg
(4)A和E组成的最简单化合物的结构式

(5)用电子式表示B和H组成化合物的形成过程

(6)H的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式6H++Al2O3=2Al3++3H2O.
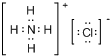 .
. A、B、C、D是由短周期元素形成的单质.B、E均为组成空气的成分.化合物F的焰色反应呈黄色.在G中,非金属元素与金属元素的原子个数比为1:2.在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):
A、B、C、D是由短周期元素形成的单质.B、E均为组成空气的成分.化合物F的焰色反应呈黄色.在G中,非金属元素与金属元素的原子个数比为1:2.在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出): .
.