题目内容
7.工业上常以富含硫酸亚铁的废液为原料生产氧化铁,其主要流程如下:废液$→_{①}^{提纯、结晶}$FeSO4•7H2O$\stackrel{②}{→}$FeSO4溶液$→_{③}^{NH_{4}HCO_{3}溶液}$FeCO3$\stackrel{④}{→}$Fe2O3
(1)已知步骤①中硫酸亚铁在不同温度下的溶解度和析出晶体的组成如下表所示.
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
(2)步骤②需加一定量硫酸,其主要目的是抑制FeSO4的水解.
(3)生产FeCO3浊液的离子方程式为Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;FeCO3浊液露置在空气中会出现红褐色的固体,该变化的化学方程式为4FeCO3+6H2O+O2═4Fe(OH)3+4CO2.
(4)已知FeSO4•7H2O浊液晶体在加热条件下发生如下反应:FeSO4•7H2O$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O↑;利用如图装置可检验该反应的气体产物.
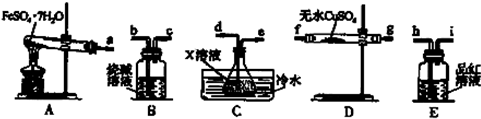
请填写下列空白:
①仪器的连接顺序为a接f(或g)、g(或f)接d、e接h、i接b.
②装置C中的X为氯化钡溶液.
分析 以富含硫酸亚铁的废液为原料生产氧化铁,其主要流程:废液结晶得到FeSO4•7H2O,加一定量硫酸溶解,抑制FeSO4的水解,加入碳酸氢铵,FeSO4溶液中加入碳酸氢铵经反应可生成碳酸亚铁固体和硫酸铵溶液,碳酸亚铁固体经洗涤、干燥,在空气中灼烧时发生分解,且与空气中的氧气发生氧化还原反应,可生成Fe2O3.
(1)依据图表数据分析,析出晶体FeSO4•7H2O的温度范围;
(2)亚铁离子水解显酸性,加一定量硫酸能抑制水解;
(3)亚铁离子与碳酸氢根离子反应生成碳酸亚铁沉淀和二氧化碳、水;FeCO3与氧气、水反应生成氢氧化铁和二氧化碳;
(4)实验装置A中FeSO4•7H2O分解生成的有二氧化硫、三氧化硫和水蒸气,B装置吸收尾气,C装置冷却是为了吸收三氧化硫,D装置无水硫酸铜检验产无水,E装置品红溶液检验SO2.
①分解生成的有二氧化硫、三氧化硫和水蒸气,利用图3装置可检验该反应的气体产物,先利用D装置检验生成的水蒸气,通过C装置冷却是为了吸收三氧化硫,通过装置E检验二氧化硫气体的存在,最后剩余气体通过B装置吸收尾气;
②装置C中是氯化钡溶液.
解答 解:(1)依据图表数据分析,0℃时析出晶体FeSO4•7H2O14g,t>56.7℃时析出晶体FeSO4•4H2O,所以析出晶体FeSO4•7H2O的温度范围应为t<56.7℃,
故答案为:t<56.7℃;
(2)步骤②需加一定量硫酸,除了保证铁屑充分反应外,由于亚铁离子水解显酸性,加过量硫酸,增大H+浓度,使Fe2++2H2O?Fe(OH)2+2H+的平衡向逆反应方向移动,从而抑制Fe2+的水解;
故答案为:抑制FeSO4的水解;
(3)亚铁离子与碳酸氢根离子反应生成碳酸亚铁沉淀和二氧化碳、水,其反应的离子方程式为:Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;
FeCO3与氧气、水反应生成氢氧化铁和二氧化碳,其化学方程式为:4FeCO3+6H2O+O2═4Fe(OH)3+4CO2;
故答案为:Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;4FeCO3+6H2O+O2═4Fe(OH)3+4CO2;
(4)①分解生成的有二氧化硫、三氧化硫和水蒸气,利用图3装置可检验该反应的气体产物,先利用D装置检验生成的水蒸气,通过C装置冷却是为了吸收三氧化硫,通过装置E检验二氧化硫气体的存在,最后剩余气体通过B装置吸收尾气,仪器的连接顺序为a、f(或g)、g(或f)、d、e、h、i、b,
故答案为:f(或g);g(或f);d;e;h;i;b;
②通过C装置冷却是为了吸收三氧化硫,装置C中的X为吸收三氧化硫的氯化钡溶液,
故答案为:氯化钡溶液.
点评 本题考查生产氧化铁化学工业流程、FeSO4•7H2O受热产物的检验,主要是物质性质和制备性质的理解和实验基本操作的分析判断,侧重于考查学生对所学知识的应用能力,及实验探究能力,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | $\frac{a}{4b}$mol-1 | B. | $\frac{4b}{a}$ mol-1 | C. | $\frac{a}{b}$ mol-1 | D. | $\frac{b}{4a}$ mol-1 |
| A. | 5.6L | B. | 6.75L | C. | 13.44L | D. | 11.2L |
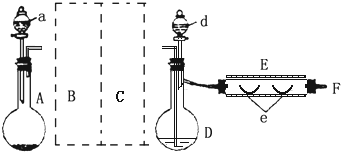 实验室制溴化亚铁可以用图示的装置:装置中A为CO2发生装置;D和d中均盛有液溴;E为外套电炉丝的不锈钢管;e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将铁粉加热至600~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,随反应的进行将d中液溴滴入到D中.经过几个小时的连续反应,在钢管的一端沉积有80g黄绿色鳞片状溴化亚铁.(溴的沸点:58.78℃,并对有机物有腐蚀性)
实验室制溴化亚铁可以用图示的装置:装置中A为CO2发生装置;D和d中均盛有液溴;E为外套电炉丝的不锈钢管;e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将铁粉加热至600~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,随反应的进行将d中液溴滴入到D中.经过几个小时的连续反应,在钢管的一端沉积有80g黄绿色鳞片状溴化亚铁.(溴的沸点:58.78℃,并对有机物有腐蚀性) .
. .
.