题目内容
12.写出下列反应的化学方程式:(1)实验室制取乙烯的化学方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)2-溴丙烷与氢氧化钠的乙醇溶液共热CH3CHBrCH3+NaOH$→_{△}^{乙醇氢氧化钠}$CH2=CHCH3↑+H2O+NaBr.
(3)乙醛与新制氢氧化铜悬浊液反应CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O+3H2O.
(4)苯酚稀溶液滴加到溴水中发生反应
 .
.(5)实验室制取酚醛树脂
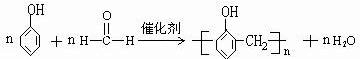 .
.(6)蔗糖发生水解反应C12H22O11+H2O$\stackrel{催化剂}{→}$C6H12O6(葡萄糖)+C6H12O6(果糖).
分析 (1)实验室制备乙烯所用的原料为乙醇,浓硫酸作催化剂、脱水剂,反应温度为170℃,乙醇分子内脱水生成乙烯和水;
(2)2-溴丙烷与氢氧化钠乙醇溶液共热发生消去反应生成丙烯;
(3)乙醛与新制氢氧化铜悬浊液在加热条件下发生氧化还原反应;
(4)苯酚与浓溴水反应生成2,4,6-三溴苯酚;
(5)酚醛树脂是由苯酚和甲醛在催化剂条件下缩聚而成;
(6)蔗糖水解生成葡萄糖和果糖.
解答 解:(1)实验室用乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应制备乙烯,方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)2-溴丙烷与氢氧化钠乙醇溶液共热发生消去反应生成丙烯,化学方程式:CH3CHBrCH3+NaOH$→_{△}^{乙醇氢氧化钠}$CH2=CHCH3↑+H2O+NaBr;
故答案为:CH3CHBrCH3+NaOH$→_{△}^{乙醇氢氧化钠}$CH2=CHCH3↑+H2O+NaBr;
(3)乙醛与新制氢氧化铜悬浊液在加热条件下发生氧化还原反应,反应的方程式为CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O+3H2O,
故答案为:CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O+3H2O;
(4)苯酚与浓溴水反应生成2,4,6-三溴苯酚,化学方程式: ;
;
故答案为: ;
;
(5)酚醛树脂是由苯酚和甲醛在催化剂条件下缩聚而成,化学方程式: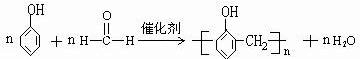 ;
;
故答案为: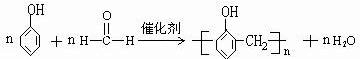 ;
;
(6)蔗糖属于双糖,蔗糖水解生成葡萄糖和果糖,化学方程式:C12H22O11+H2O$\stackrel{催化剂}{→}$C6H12O6(葡萄糖)+C6H12O6(果糖);
故答案为:C12H22O11+H2O$\stackrel{催化剂}{→}$C6H12O6(葡萄糖)+C6H12O6(果糖).
点评 本题考查化学方程式书写,熟悉物质的结构及性质是解题关键,注意反应条件的书写,题目难度不大.

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案| A. | 摩尔质量g•mol-1 | |
| B. | 气体摩尔体积L•mol-1 | |
| C. | 铁原子的摩尔质量等于它的相对原子质量 | |
| D. | 一个钠原子的质量约等于$\frac{23}{6.02×1{0}^{23}}$g |
废液$→_{①}^{提纯、结晶}$FeSO4•7H2O$\stackrel{②}{→}$FeSO4溶液$→_{③}^{NH_{4}HCO_{3}溶液}$FeCO3$\stackrel{④}{→}$Fe2O3
(1)已知步骤①中硫酸亚铁在不同温度下的溶解度和析出晶体的组成如下表所示.
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
(2)步骤②需加一定量硫酸,其主要目的是抑制FeSO4的水解.
(3)生产FeCO3浊液的离子方程式为Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;FeCO3浊液露置在空气中会出现红褐色的固体,该变化的化学方程式为4FeCO3+6H2O+O2═4Fe(OH)3+4CO2.
(4)已知FeSO4•7H2O浊液晶体在加热条件下发生如下反应:FeSO4•7H2O$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O↑;利用如图装置可检验该反应的气体产物.
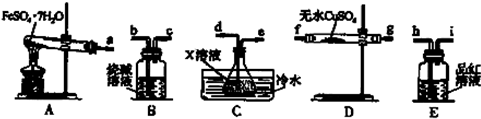
请填写下列空白:
①仪器的连接顺序为a接f(或g)、g(或f)接d、e接h、i接b.
②装置C中的X为氯化钡溶液.
| A. | 胶体粒子的直径在1~100 nm之间 | |
| B. | 氢氧化铁胶体带电 | |
| C. | 可用渗析的方法分离蛋白质和氯化钠的混合溶液 | |
| D. | 胶体能稳定存在的主要原因是胶体粒子带电荷 |
| A. | 首先称取NaOH固体8.8g | |
| B. | 容量瓶中原有少量蒸馏水没有影响 | |
| C. | 定容后,将容量瓶振荡均匀,静置时发现液面低于刻度线,于是又加少量水至刻度线 | |
| D. | 定容时仰视刻度线会使所配制的溶液浓度偏高 |
| A. | ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| B. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| C. | 同主族元素的简单阴离子还原性从上到下依次减弱 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |