题目内容
12.一定量的液态化合物XY2与O2恰好完全反应,化学方程式为XY2(1)+3O2(g)═XO(g)+2YO2(g),反应冷却后,在标准状况下测得生成物的体积为672mL,密度为2.56g•L-1.回答下列问题:(1)标准状况下,反应前O2的体积是672mL.
(2)化合物XY的摩尔质量是76g/mol
(3)在XY2分子中,若X、Y两种元素的质量之比为3:16,则X、Y两元素分别为碳和硫(填名称)
分析 (1)由方程式可知,反应前后气体的体积不发生变化,据此计算氧气的体积;
(2)标准状况下,气体摩尔质量M=Vm×ρ,据此计算混合气体的摩尔质量和质量;根据方程式计算的物质的量XY2,再计算XY2的摩尔质量;
(3)根据XY2分子中,若X、Y两种元素的质量之比为3:16,以及XY2的摩尔质量计算X、Y的相对原子质量,再判断元素.
解答 解:(1)由方程式可知,反应前后气体的体积不发生变化,反应后的气体和氧气的关系式为1:1,故V(O2)=672mL,
故答案为:672;
(2)标准状况下,气体摩尔质量M=Vm×ρ,气体反应后混合气体的摩尔质量=22.4L/mol×2.56g/L=57.344g/mol,
672mL混合气体的物质的量=$\frac{0.672L}{22.4L/mol}$=0.03mol,n(O2)=0.03mol,则n(XY2)=0.01mol,
m(XY2)=m(混合气体)-m(O2)=0.03mol×57.344g/mol-0.03mol×32g/mol=0.76g
故Mr(XY2)=$\frac{0.76g}{0.01mol}$=76g/mol,
故答案为:76g/mol;
(3)XY2分子中X、Y两元素的质量比为3:16,
则1molXY2中含有X的质量为76g×$\frac{3}{3+16}$=12g,Y的质量为76g-12g=64g,
1molXY2中含有X1mol,Y2mol,
所以X的相对原子质量为12,Y的相对原子质量为32,
X为碳元素,Y为硫元素,
故答案为:碳;硫.
点评 本题考查化学方程式的有关计算,题目难度中等,注意根据方程式的特征计算氧气的体积,理解气体的摩尔质量与密度的关系.

练习册系列答案
相关题目
2.下列各溶液中,分别加入Na2O2后都会既放出气体又有固体析出的是( )
| A. | FeCl3稀溶液 | B. | NaCl稀溶液 | C. | 饱和Ca(OH)2溶液 | D. | 饱和NaHCO3溶液 |
7.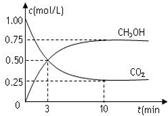 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法错误的是( )
在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法错误的是( )
 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法错误的是( )
在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法错误的是( )| A. | 该密闭容器的体积为1L | |
| B. | 反应达平衡,氢气的转化率为0.75 | |
| C. | 反应达平衡,氢气平均反应速率0.075mol/(L•min) | |
| D. | CO2或H2O物质的量不再改变时反应达平衡 |
4.下面叙述正确的是( )
| A. | 工业上用过量的碳还原二氧化硅而得到作为半导体材料的硅 | |
| B. | 二氧化硅除可用于制作光学镜片、石英坩埚外,还可用于制造光导纤维 | |
| C. | 水玻璃中加入少量盐酸出现白色沉淀,盐酸过量时,沉淀溶解 | |
| D. | 在Si+2NaOH+H2O═Na2SiO3+2H2↑反应中,NaOH和水均作氧化剂 |
7.工业上常以富含硫酸亚铁的废液为原料生产氧化铁,其主要流程如下:
废液$→_{①}^{提纯、结晶}$FeSO4•7H2O$\stackrel{②}{→}$FeSO4溶液$→_{③}^{NH_{4}HCO_{3}溶液}$FeCO3$\stackrel{④}{→}$Fe2O3
(1)已知步骤①中硫酸亚铁在不同温度下的溶解度和析出晶体的组成如下表所示.
若从硫酸亚铁溶液中结晶出FeSO4•7H2O,控制的温度(t)为t<56.7℃.
(2)步骤②需加一定量硫酸,其主要目的是抑制FeSO4的水解.
(3)生产FeCO3浊液的离子方程式为Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;FeCO3浊液露置在空气中会出现红褐色的固体,该变化的化学方程式为4FeCO3+6H2O+O2═4Fe(OH)3+4CO2.
(4)已知FeSO4•7H2O浊液晶体在加热条件下发生如下反应:FeSO4•7H2O$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O↑;利用如图装置可检验该反应的气体产物.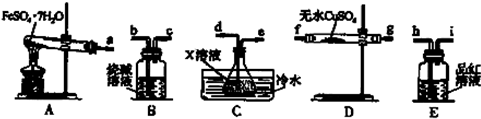
请填写下列空白:
①仪器的连接顺序为a接f(或g)、g(或f)接d、e接h、i接b.
②装置C中的X为氯化钡溶液.
废液$→_{①}^{提纯、结晶}$FeSO4•7H2O$\stackrel{②}{→}$FeSO4溶液$→_{③}^{NH_{4}HCO_{3}溶液}$FeCO3$\stackrel{④}{→}$Fe2O3
(1)已知步骤①中硫酸亚铁在不同温度下的溶解度和析出晶体的组成如下表所示.
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
(2)步骤②需加一定量硫酸,其主要目的是抑制FeSO4的水解.
(3)生产FeCO3浊液的离子方程式为Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;FeCO3浊液露置在空气中会出现红褐色的固体,该变化的化学方程式为4FeCO3+6H2O+O2═4Fe(OH)3+4CO2.
(4)已知FeSO4•7H2O浊液晶体在加热条件下发生如下反应:FeSO4•7H2O$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O↑;利用如图装置可检验该反应的气体产物.

请填写下列空白:
①仪器的连接顺序为a接f(或g)、g(或f)接d、e接h、i接b.
②装置C中的X为氯化钡溶液.
8.下列各组气体中,在通常条件下能稳定共存的是( )
| A. | NH3、HCl | B. | H2S、SO2 | C. | NO、O2 | D. | N2、O2 |