题目内容
2.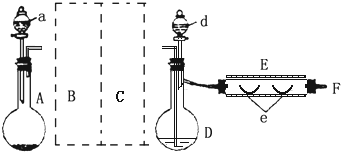 实验室制溴化亚铁可以用图示的装置:装置中A为CO2发生装置;D和d中均盛有液溴;E为外套电炉丝的不锈钢管;e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将铁粉加热至600~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,随反应的进行将d中液溴滴入到D中.经过几个小时的连续反应,在钢管的一端沉积有80g黄绿色鳞片状溴化亚铁.(溴的沸点:58.78℃,并对有机物有腐蚀性)
实验室制溴化亚铁可以用图示的装置:装置中A为CO2发生装置;D和d中均盛有液溴;E为外套电炉丝的不锈钢管;e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将铁粉加热至600~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,随反应的进行将d中液溴滴入到D中.经过几个小时的连续反应,在钢管的一端沉积有80g黄绿色鳞片状溴化亚铁.(溴的沸点:58.78℃,并对有机物有腐蚀性)请回答以下问题:
(1)对于装置D最好采用水浴加热的方式来得到溴蒸气.
(2)若导入的CO2不干燥,会在E中发生副反应,其化学方程式为:3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2↑;
(3)若在A中盛固体CaCO3,a中盛6mol/L的盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:
B为盛有饱和NaHCO3溶液的洗气瓶;
C为盛有浓H2SO4的洗气瓶.
(4)实验时,装置D和E的橡皮塞最好用锡箔包住,原因是:Br2有腐蚀性,腐蚀橡胶塞.
(5)反应过程中要不断通入CO2,其主要作用是:
①排净容器里的空气;
②将Br2蒸气带入反应器中.
(6)为防止污染空气,应将F处出来的气体通入盛有碱液的洗气瓶.
(7)E中的反应为:2Fe+3Br2$\frac{\underline{\;\;△\;\;}}{\;}$2FeBr3;2FeBr3$\frac{\underline{\;\;△\;\;}}{\;}$ 2FeBr2+Br2↑
此实验中溴化亚铁的产率为37.04%.
分析 (1)溴的沸点:58.78℃,可用水浴的方法加热得到溴蒸气;
(2)若导入的CO2不干燥含有水蒸气,铁与水蒸气在加热的条件下反应生成四氧化三铁和氢气;
(3)装置B用于除去二氧化碳中的氯化氢气体;装置D作用是干燥二氧化碳;
(4)根据溴能够腐蚀橡胶塞分析;
(5)通入二氧化碳,可以将容器中的空气赶净,将Br2蒸气带入反应器D中;
(6)溴蒸汽有毒,不能排到空气中,可以用碱液如氢氧化钠溶液吸收未反应的溴单质;
(7)根据题中信息生成了80g溴化亚铁,计算出56g铁粉完全反应理论上能够生成溴化亚铁的质量,再计算出溴化亚铁的产率.
解答 解:(1)溴的沸点:58.78℃,低于水的沸点100℃,用水浴加热,使反应容器内溴受热温度均匀,均匀产生溴蒸汽,
故答案为:水浴;
(2)若导入的CO2不干燥含有水蒸气,会在E中发生副反应,铁与水蒸气生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2↑,
故答案为:3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2↑;
(3)装置B用于除去二氧化碳中的氯化氢气体,可以用盛有NaHCO3饱和溶液的洗气瓶洗气;装置D作用是干燥二氧化碳,可以用盛有浓H2SO4的洗气瓶干燥,
故答案为:盛有饱和NaHCO3溶液的洗气瓶;盛有浓H2SO4的洗气瓶;
(4)D和d中均盛有液溴,溴单质能够腐蚀橡胶塞,适宜装置D和E的橡皮塞最好用锡箔包住,
故答案为:Br2有腐蚀性,腐蚀橡胶塞;
(5)反应过程中要不断地通入CO2,其主要作用是为:反应前将容器中的空气赶净,避免空气中的氧气干扰实验;反应过程中要不断通入CO2,还可以将Br2蒸气带入反应器D中,使溴能够与铁粉充分反应,
故答案为:①排净容器里的空气;②将Br2蒸气带入反应器中;
(6)溴蒸汽有毒,不能排到空气中,可被碱液吸收,如氢氧化钠溶液能够与溴单质反应,适宜为防止污染空气,实验时应在F处连接盛有碱液如氢氧化钠溶液的尾气吸收装置,
故答案为:盛有碱液的洗气瓶;
(7)根据关系式由Fe~FeBr2可算出,56g铁粉完全反应,理论上应生成溴化铁216g,
所以FeBr2的产率为:$\frac{80g}{216g}$×100%≈37.04%,
故答案为:37.04%.
点评 本题考查了制取溴化亚铁方案设计,涉及的内容均是中学化学中的基础知识及基本技能,充分考查了学生的分析、理解能力及灵活应用化学知识的能力,是一道质量较高的题目,难度中等.

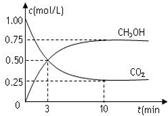 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法错误的是( )
在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法错误的是( )| A. | 该密闭容器的体积为1L | |
| B. | 反应达平衡,氢气的转化率为0.75 | |
| C. | 反应达平衡,氢气平均反应速率0.075mol/(L•min) | |
| D. | CO2或H2O物质的量不再改变时反应达平衡 |
| A. | 工业上用过量的碳还原二氧化硅而得到作为半导体材料的硅 | |
| B. | 二氧化硅除可用于制作光学镜片、石英坩埚外,还可用于制造光导纤维 | |
| C. | 水玻璃中加入少量盐酸出现白色沉淀,盐酸过量时,沉淀溶解 | |
| D. | 在Si+2NaOH+H2O═Na2SiO3+2H2↑反应中,NaOH和水均作氧化剂 |
废液$→_{①}^{提纯、结晶}$FeSO4•7H2O$\stackrel{②}{→}$FeSO4溶液$→_{③}^{NH_{4}HCO_{3}溶液}$FeCO3$\stackrel{④}{→}$Fe2O3
(1)已知步骤①中硫酸亚铁在不同温度下的溶解度和析出晶体的组成如下表所示.
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
(2)步骤②需加一定量硫酸,其主要目的是抑制FeSO4的水解.
(3)生产FeCO3浊液的离子方程式为Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;FeCO3浊液露置在空气中会出现红褐色的固体,该变化的化学方程式为4FeCO3+6H2O+O2═4Fe(OH)3+4CO2.
(4)已知FeSO4•7H2O浊液晶体在加热条件下发生如下反应:FeSO4•7H2O$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O↑;利用如图装置可检验该反应的气体产物.
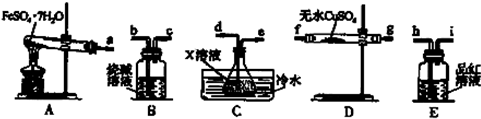
请填写下列空白:
①仪器的连接顺序为a接f(或g)、g(或f)接d、e接h、i接b.
②装置C中的X为氯化钡溶液.
| A. | HNO3 | B. | H2O2 | C. | KClO3 | D. | Na2O2 |
| A. | 合成氨工业中采用高压条件 | |
| B. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| C. | 用排饱和食盐水的方法收集Cl2 | |
| D. | 在含有[Fe(SCN)]2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
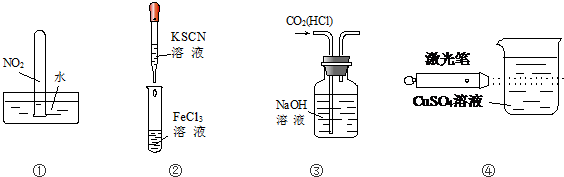
| A. | 实验①试管最终会充满水 | |
| B. | 实验②试管中溶液变为血红色 | |
| C. | 可用实验③装置除去CO2气体中含有的少量HCl杂质 | |
| D. | 实验④可观察丁达尔现象 |