题目内容
20.一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相同,将 1.0L这种混合气体在氧气中充分燃烧,生成2.0LCO2和2.4L水蒸气(相同条件下测定).则混合物中烷烃和烯烃的体积比为( )| A. | 3:1 | B. | 1:3 | C. | 2:3 | D. | 3:2 |
分析 1体积的这两种气体的混合物在氧气中完全燃烧,生成2体积的二氧化碳和2.4体积的水蒸气,则平均碳原子数为:$\frac{2}{1}$=2,平均氢原子数为:$\frac{2.4×2}{1}$=4.8;二者分子中碳原子数相等,则都含有2个碳原子,应该为乙烷和乙烯的混合物;设乙烷的体积为x,乙烯的体积为y,根据混合物中平均氢原子数列式计算出x:y即可.
解答 解:相同条件下,气体的体积之比等于物质的量之比,1体积的这两种气体的混合物在氧气中完全燃烧,生成2体积的二氧化碳和2.4体积的水蒸气,混合气体的物质的量与生成二氧化碳的物质的量之比为:1:2,则混合气体中平均碳原子数为:$\frac{2}{1}$=2,
混合物体积与水的物质的量之比为:1:4.8,则混合物中平均氢原子数为:$\frac{2.4×2}{1}$=4.8,
由于烯烃和烷烃分子中的碳原子数相等,则混合物为乙烷和乙烯,
设乙烷的体积为x,乙烯的体积为y,
混合物中平均氢原子数为:$\frac{6x+4y}{x+y}$=4.8,
解得:x:y=2:3,
故选C.
点评 本题考查混合物反应的计算,题目难度中等,注意掌握混合烃燃烧的计算方法,明确平均分子式法在计算中的运用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
10.关于化学键的叙述中,正确的是( )
| A. | 单质、共价化合物、离子化合物中都存在共价键 | |
| B. | 金属和非金属所形成的化学键均为离子键 | |
| C. | 阴、阳离子通过静电引力而形成的化学键叫做离子键 | |
| D. | 共价化合物中一定不含离子键 |
11.如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )

| A. | 常压下Z的单质沸点最高 | B. | 电负性W小于Y | ||
| C. | W的氢化物比X的氢化物稳定 | D. | R的单质在固态时属于原子晶体 |
8.下列物质中,所含化学键类型完全相同的是( )
| A. | CaCl2 K2S | B. | CO2 Na2O2 | C. | NaOH HCl | D. | NH4Cl CaH2 |
5.下列物质充分反应后,滴入KSCN溶液,显红色的是( )
| A. | FeO+HNO3(溶液) | B. | 过量铁+稀硫酸 | ||
| C. | FeCl3(溶液)+过量铁 | D. | Fe+CuSO4(溶液) |
12.下列说法正确的是( )
| A. | 室温时,在水电离出c(H+)=1.0×10-12mol•L-1的溶液中,K+、Na+、HCO3-、Cl-一定能大量共存 | |
| B. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 常温下,pH=2的醋酸溶液中所含有的H+数为0.01 NA | |
| D. | 将92 g N2O4晶体放入容器中,恢复到常温常压时,所含气体分子数大于NA |
9.下列说法中正确的是( )
| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 反应产物的总焓大于反应物的总焓时,△H>0 | |
| C. | △H的大小与热化学方程式中的各物质的化学计量数无关 | |
| D. | 在化学反应中,发生物质变化的同时不一定发生能量变化 |
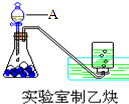 (1)实验室制取乙炔的实验装置图(如图)中,A仪器的名称为分液漏斗;所盛的试剂为饱和食盐水.发生反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑.
(1)实验室制取乙炔的实验装置图(如图)中,A仪器的名称为分液漏斗;所盛的试剂为饱和食盐水.发生反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑.