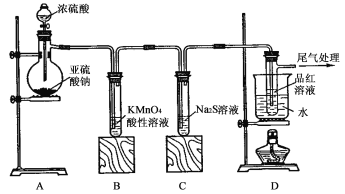
题目内容
【题目】为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
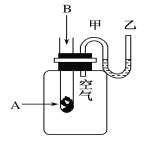
(1)该反应为________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量 ________(填“高”或“低”)。
(3)物质中的化学能通过________转化成________释放出来。
(4)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:_____________________________________。
【答案】(1)放热
(2)高
(3)化学反应 热能
(4)低
(5)2Al+6HCl===2AlCl3+3H2↑(或2Na+2H2O===2NaOH+H2↑或 NaOH+ HCl===NaCl+H2O
【解析】
试题分析:(1)U形管中甲处液面下降乙处液面上升,说明试管中的反应是放热反应使得瓶子里的压强增大,能推动U型管中的液面,使液面出现左低右高的现象;(2)反应物的总能量高于生成物的总能量时,反应为放热反应,故填写“高”(3)物质中的化学能通过化学反应转化成热能释放出来;(4)断裂化学键需要吸收的能量低于生成物形成化学键释放的能量时,反应为放热反应;(5)金属与酸反应为放热反应,故可以为2Al+6HCl===2AlCl3+3H2↑(或2Na+2H2O===2NaOH+H2↑或 NaOH+ HCl===NaCl+H2O

 阅读快车系列答案
阅读快车系列答案【题目】甲醇是重要的化工原料,又可称为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ/mol
CH3OH(g)+H2O(g) △H=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41 kJ/mol
CO(g)+H2O(g) △H=+41 kJ/mol
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | x |
则x=_________。
(2)若T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间变化如图中状态Ⅰ(图中实线)所示。图中数据A(1,6)代表在1min时H2的物质的量是6mol。

①T℃时状态Ⅰ条件下,0~3min内CH3OH的平均反应速率v=_____________mol/(L·min),平衡常数K=____;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是_______;
③其他条件不变,仅改变温度时,测得H2的物质的量随时间变化如图中状态Ⅲ所示,则状态Ⅲ对应的温度________(填“>”“<”或“=”)T℃;
④若状态Ⅱ的平衡常数为K2,状态Ⅲ的平衡常数为K3,则K2____(填“>”“<”或“=”)K3;
⑤一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是_____。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂