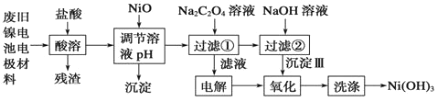
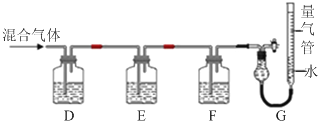
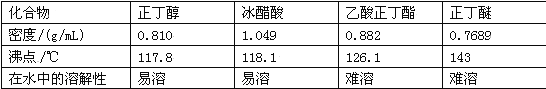
题目内容
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________。
②Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是__________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为690pm和780pm。则熔点:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为________________。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
【答案】(1)①3d24s2;②7;
(2)①O>Cl>C;②3∶1;sp2;
(3)>;
(4)①LaNi5;②M/NAd;③1236
【解析】
试题分析:(1)①Ti是22号元素,位于元素周期表中第四周期第IVB族,故Ti的基态原子价电子排布式为 3d24s2,故答案为:3d24s2;
②Fe是26号元素,原子核外有1s、2s、3s、4s、2p、3p、3d等7个能级,故答案为:7;
(2)①反应式中非金属元素有三种:O、C、Cl,CCl4中C表现正化合价、Cl表现负化合价,CrO2Cl2中Cl为+1价,O为-2价,电负性越大,对键合电子吸引力越大,元素相互化合时该元素表现负价,故电负性:O>Cl>C,故答案为:O>Cl>C;
②COCl2分子中有1个C=O键和2个C-Cl键,所以COCl2分子中σ键的数目为3,π键的数目为1,个数比3:1,中心原子C电子对数=3+![]() ×(41×22)=3,故中心原子杂化方式为sp2,故答案为:3:1;sp2;
×(41×22)=3,故中心原子杂化方式为sp2,故答案为:3:1;sp2;
(3)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,故答案为:>;
(4)①该合金的晶胞如图所示,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点。所以晶胞实际含有的镍原子为1×1+![]() ×8=5,晶胞实际含有的镧原子为8×
×8=5,晶胞实际含有的镧原子为8×![]() =1,所以晶体的化学式LaNi5,故答案为:LaNi5;
=1,所以晶体的化学式LaNi5,故答案为:LaNi5;
②一个晶胞的质量m=![]() ,根据m=ρv,即v=
,根据m=ρv,即v=![]() ,故答案为:
,故答案为:![]() ;
;
③LaNi5合金储氢后的密度ρ=![]() =
=![]() =0.111gcm-3,由定义式:储氢能力=
=0.111gcm-3,由定义式:储氢能力=![]() ,故储氢能力=
,故储氢能力=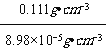 ≈1236,故答案为:1236。
≈1236,故答案为:1236。

 阅读快车系列答案
阅读快车系列答案【题目】甲醇是重要的化工原料,又可称为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ/mol
CH3OH(g)+H2O(g) △H=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41 kJ/mol
CO(g)+H2O(g) △H=+41 kJ/mol
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | x |
则x=_________。
(2)若T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间变化如图中状态Ⅰ(图中实线)所示。图中数据A(1,6)代表在1min时H2的物质的量是6mol。

①T℃时状态Ⅰ条件下,0~3min内CH3OH的平均反应速率v=_____________mol/(L·min),平衡常数K=____;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是_______;
③其他条件不变,仅改变温度时,测得H2的物质的量随时间变化如图中状态Ⅲ所示,则状态Ⅲ对应的温度________(填“>”“<”或“=”)T℃;
④若状态Ⅱ的平衡常数为K2,状态Ⅲ的平衡常数为K3,则K2____(填“>”“<”或“=”)K3;
⑤一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是_____。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
【题目】(NH4)2Fe(SO4)2·6H2O(莫尔盐,浅绿色,式量392)在定量分析中常用作标定高锰酸钾、重铬酸钾等溶液的标准物质,还用作化学试剂、医药以及用于冶金、电镀等。
回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是_______________。
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加入20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点。重复进行3次,测得有关数据如下:
实验序号 | 起始读数/mL | 终点读数/mL |
I | 2.50 | 22.58 |
Ⅱ | 1.00 | 23.12 |
Ⅲ | 0.00 | 19.92 |
①K2Cr2O7溶液应该放在______________式滴定管中。
②写出滴定过程中反应的离子方程式:______________;
③所测K2Cr2O7溶液的物质的量浓度为______________mol/L(用含M的代数式表示)。
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物。
①甲同学提出猜想:分解产物可能是N2、Fe2O3,SO3、H2O四种物质。你是否同意并说明理由:______________。
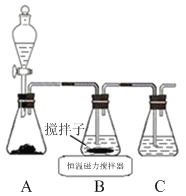
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有______________;C装置中红色褪去,说明气体产物中含有______________;

C装置后应连接尾气吸收装置D,D中盛有的试剂可以是______________(写一种即可)。
③丙同学想利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B______________、C______________。
④丁同学认为莫尔盐分解可能会生成N2,SO3,拟从下列装置中选择必要的装置加以证明。则正确的连接顺序从左到右依次是A、______________。