题目内容
(1)依据第2周期元素第一电离能的变化规律,C、N、O第一电离能大小排列是 .
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:2NH3+3F2
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有 (填序号).
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②基态铜原子的核外电子排布式为 .
(3)BF3与一定量水形成(H2O)2?BF3晶体Q,Q在一定条件下可转化为R:
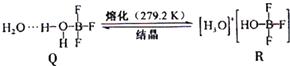
①晶体Q中各种微粒间的作用力不涉及 (填序号).
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化.
(4)已知苯酚(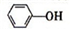 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子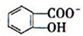 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸) Ka(苯酚)(填“>”或“<”),其原因是 .
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸) Ka(苯酚)(填“>”或“<”),其原因是 .
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:2NH3+3F2
| ||
①上述化学方程式中的5种物质所属的晶体类型有
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②基态铜原子的核外电子排布式为
(3)BF3与一定量水形成(H2O)2?BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为
(4)已知苯酚(
 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)考点:位置结构性质的相互关系应用,元素电离能、电负性的含义及应用,判断简单分子或离子的构型,原子轨道杂化方式及杂化类型判断,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素;
(2)①氨气、氟气以及NF3为分子晶体,铜为金属晶体,NH4F为离子晶体;
②Cu元素为29号元素,原子核外有29个电子,结合构造原理书写;
(3)①非金属元素原子之间易形成共价键,含有空轨道的原子和含有孤电子对的原子之间易形成配位键,分子之间存在范德华力,水分子中的O原子和其它分子中的H原子易形成氢键;
②根据价层电子对互斥理论确定H3O+空间构型、阴离子中中心原子杂化方式;
(4)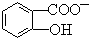 中形成分子内氢键,使其更难电离出H+.
中形成分子内氢键,使其更难电离出H+.
(2)①氨气、氟气以及NF3为分子晶体,铜为金属晶体,NH4F为离子晶体;
②Cu元素为29号元素,原子核外有29个电子,结合构造原理书写;
(3)①非金属元素原子之间易形成共价键,含有空轨道的原子和含有孤电子对的原子之间易形成配位键,分子之间存在范德华力,水分子中的O原子和其它分子中的H原子易形成氢键;
②根据价层电子对互斥理论确定H3O+空间构型、阴离子中中心原子杂化方式;
(4)
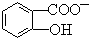 中形成分子内氢键,使其更难电离出H+.
中形成分子内氢键,使其更难电离出H+.解答:
解:(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,C、N、O中N原子最外层为半充满结构,较为稳定,所以它们的第一电离能大小顺序是I1(N)>I1(O)>I1(C),
故答案为:N>O>C;
(2)①氨气、氟气以及NF3为分子晶体,铜为金属晶体,NH4F为离子晶体,
故答案为:abd;
②Cu元素为29号元素,原子核外有29个电子,核外电子排布式为:1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(3)①非金属元素原子之间易形成共价键,B原子含有空轨道、O原子含有孤电子对,所以B原子和O原子之间存在配位键,分子之间存在范德华力,水分子中的O原子和其它分子中的H原子易形成氢键,所以不涉及的是离子键和金属键,故选ad;
②H3O+中O原子价层电子对个数=3+
(6-1-3×1)=4且含有一个孤电子对,所以为三角锥形结构,阴离子中中心原子B原子含有4个σ键且不含孤电子对,所以B原子采用sp3杂化方式,
故答案为:三角锥形;sp3;
(4)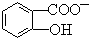 中形成分子内氢键,使其更难电离出H+,故相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚),
中形成分子内氢键,使其更难电离出H+,故相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚),
故答案为:<;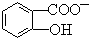 中形成分子内氢键,使其更难电离出H+.
中形成分子内氢键,使其更难电离出H+.
故答案为:N>O>C;
(2)①氨气、氟气以及NF3为分子晶体,铜为金属晶体,NH4F为离子晶体,
故答案为:abd;
②Cu元素为29号元素,原子核外有29个电子,核外电子排布式为:1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(3)①非金属元素原子之间易形成共价键,B原子含有空轨道、O原子含有孤电子对,所以B原子和O原子之间存在配位键,分子之间存在范德华力,水分子中的O原子和其它分子中的H原子易形成氢键,所以不涉及的是离子键和金属键,故选ad;
②H3O+中O原子价层电子对个数=3+
| 1 |
| 2 |
故答案为:三角锥形;sp3;
(4)
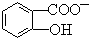 中形成分子内氢键,使其更难电离出H+,故相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚),
中形成分子内氢键,使其更难电离出H+,故相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚),故答案为:<;
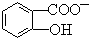 中形成分子内氢键,使其更难电离出H+.
中形成分子内氢键,使其更难电离出H+.
点评:本题考查了粒子空间构型的判断、原子杂化方式的判断、第一电离能、化学键等知识点,这些知识点都是高考高频点,根据价层电子对互斥理论、元素周期律等知识点来分析解答即可,注意第一电离能的规律及异常现象,为易错点.

练习册系列答案
相关题目
苯分子中不存在碳碳单、双键的交替结构,下列可以作为证据的事实是( )
①苯不能使酸性KMnO4溶液褪色
②苯不能因发生化学反应而使溴的四氯化碳溶液褪色
③苯在加热和有催化剂存在的条件下能与H2加成生成环已烷
④苯分子中碳碳键长完全相等
⑤邻二氯苯( )只有一种
)只有一种
⑥间二氯苯(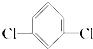 )只有一种.
)只有一种.
①苯不能使酸性KMnO4溶液褪色
②苯不能因发生化学反应而使溴的四氯化碳溶液褪色
③苯在加热和有催化剂存在的条件下能与H2加成生成环已烷
④苯分子中碳碳键长完全相等
⑤邻二氯苯(
 )只有一种
)只有一种⑥间二氯苯(
 )只有一种.
)只有一种.| A、①② | B、①⑤ |
| C、③④⑤⑥ | D、①②④⑤ |
某溶液中含有NH4+、Mg2+、Fe2+、Al3+、SO42-五种离子,若向其中加入过量的氢氧化钡溶液,微热并搅拌,再加入过量的氢碘酸,溶液中大量减少的离子有( )
| A、4 种 |
| B、3 种 |
| C、2 种 |
| D、1 种 |
下列事实不能用勒夏特列原理解释的是( )
| A、打开啤酒瓶盖,瓶口冒出大量气泡 |
| B、合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率 |
| C、由H2、I2(g)、HI(g)气体组成的平衡体系减压后颜色变浅 |
| D、工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来 |
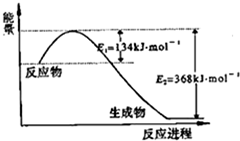 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
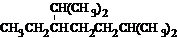 的名称是
的名称是