题目内容
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
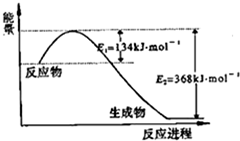
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.(1)图是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
已知:N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ?mol-1,则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H=
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
②反应达到平衡后,NO2的转化率为
A.降低温度 B.充入氦气,使体系压强增大 C.再充入NO2 D.再充入4mol NO2和1mol O2.
考点:热化学方程式,用盖斯定律进行有关反应热的计算,化学平衡的影响因素,化学平衡的计算
专题:化学反应中的能量变化,化学平衡专题
分析:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;然后根据盖斯定律来解答;
(2)①化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;温度低,化学平衡常数大,则正反应放热;
②NO2转化率为已转化的NO2物质的量与起始物质的量的百分比;增大NO2的转化率,促进反应的正向移动即可;
(2)①化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;温度低,化学平衡常数大,则正反应放热;
②NO2转化率为已转化的NO2物质的量与起始物质的量的百分比;增大NO2的转化率,促进反应的正向移动即可;
解答:
解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为:
NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1 ①
又有N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ?mol-1②
将2①-②可得:2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H=-760.3KJ/mol.
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1;-760.3KJ/mol
(2)①化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,即K=
;温度低,化学平衡常数大,则正反应放热,故答案为:
,放热;
②转化的NO2的物质的量为20mol-10.08mol=9.92mol,转化率为
×100%=49.6%;
A、该反应为放热反应,降低温度,化学平衡向右移动,故A正确;
B、反应气体浓度不变,化学平衡不移动,故B错误;
C、再充入NO2,转化的物质的量增大,但是起始的物质的量增大较多,转化率降低,故C错误;
D、加入气体比例与原平衡NO2的转化率相同,由于加入气体后,体系压强增大,NO2的转化率增大,故D正确;
故选AD;
NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1 ①
又有N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ?mol-1②
将2①-②可得:2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H=-760.3KJ/mol.
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1;-760.3KJ/mol
(2)①化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,即K=
| c2(N2O5) |
| c4(NO2)?c(O2) |
| c2(N2O5) |
| c4(NO2)?c(O2) |
②转化的NO2的物质的量为20mol-10.08mol=9.92mol,转化率为
| 9.92mol |
| 20mol |
A、该反应为放热反应,降低温度,化学平衡向右移动,故A正确;
B、反应气体浓度不变,化学平衡不移动,故B错误;
C、再充入NO2,转化的物质的量增大,但是起始的物质的量增大较多,转化率降低,故C错误;
D、加入气体比例与原平衡NO2的转化率相同,由于加入气体后,体系压强增大,NO2的转化率增大,故D正确;
故选AD;
点评:本题考查化学平衡影响因素、化学平衡的计算,题目计算量较大,难度较大,关键是构建平衡建立的等效途径,中注意从正、逆不同方向建立的等效平衡转化率、反应热的关系.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
烃类物质是指( )
| A、含有碳元素的有机物 |
| B、含有碳、氢元素的有机物 |
| C、只含碳、氢两种元素的有机物 |
| D、完全燃烧,只生成二氧化碳和水的有机物 |
下列有机物的命名正确的是( )
| A、2-乙基丁烷 |
| B、3,3-二甲基丁烷 |
| C、3-甲基-2-丁烯 |
D、 1,4-二甲苯 1,4-二甲苯 |
 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)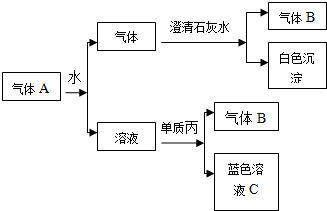 将红热固体单质甲放在显黄色的溶液乙中剧烈反应,产生混合气体A,A在常温下(不与空气接触)有如下变化:
将红热固体单质甲放在显黄色的溶液乙中剧烈反应,产生混合气体A,A在常温下(不与空气接触)有如下变化: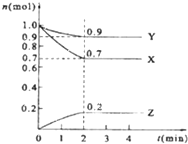 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示:
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示: