题目内容
某溶液中含有NH4+、Mg2+、Fe2+、Al3+、SO42-五种离子,若向其中加入过量的氢氧化钡溶液,微热并搅拌,再加入过量的氢碘酸,溶液中大量减少的离子有( )
| A、4 种 |
| B、3 种 |
| C、2 种 |
| D、1 种 |
考点:离子反应发生的条件
专题:离子反应专题
分析:NH4+与碱在微热时反应生成氨气逸出,则铵根离子减少,Fe2+和氢氧化钠溶液反应生成的Fe(OH)2沉淀在空气中不稳定,迅速氧化生成Fe(OH)3,则Fe2+减少,SO42-生成硫酸钡沉淀,Mg2+、Al3+与氢氧根离子反应转化为氢氧化镁沉淀、偏铝酸根离子,最后加入过量HI后,HI和氢氧化铁发生氧化还原反应,和偏铝酸根、氢氧化镁反应,以此来解答.
解答:
解:混合溶液中加入过量的氢氧化钡并加热时,反应生成的氨气逸出,并同时生成BaSO4、Mg(OH)2、Fe(OH)2沉淀和BaAlO2,Fe(OH)2沉淀在空气中不稳定,迅速氧化生成Fe(OH)3,再向混合物中加入过量的氢碘酸,则Mg(OH)2、Fe(OH)3和NaAlO2与过量酸作用分别生成MgI2、AlI3、FeI2,
则减少的离子主要有NH4+和SO42-,
故选C.
则减少的离子主要有NH4+和SO42-,
故选C.
点评:本题考查离子之间的反应,明确阳离子与碱反应后的生成物的性质及生成物与酸的反应是解答本题的关键,注意亚铁离子易被氧化是学生解答中容易忽略的地方.

练习册系列答案
相关题目
元素X、Y、Z的原子序数都小于18,X的阳离子,Y的阳离子和Z的阴离子都具有相同的电子层结构,Y的阳离子半径小于X的阳离子半径,则元素X、Y、Z的原子序数由小到大的顺序依次是( )
| A、Z、Y、X |
| B、Y、Z、X |
| C、Y、X、Z |
| D、Z、X、Y |
下列离子方程式不正确的是( )
| A、碳酸氢钙溶液跟盐酸反应:Ca(HC03)2+2H+═Ca2++2H20+2C02↑ |
| B、碘化钾溶液跟适量溴水反应:2I-+Br2═I2+2Br- |
| C、将金属锂加入水中:2Li+2H20═2Li++20H-+H2↑ |
| D、将氯气通人氯化亚铁溶液中2Fe2++Cl2═2Fe3++2Cl- |
下列说法正确的是( )
| A、乙烯和乙烷都能发生加聚反应 |
| B、苯酚俗名石炭酸,向苯酚溶液中滴入石蕊试液变浅红色 |
| C、米酒变酸的过程涉及氧化反应 |
| D、卤代烃水解和油脂皂化都有高分子生成小分子的过程 |
下列有机物的命名正确的是( )
| A、2-乙基丁烷 |
| B、3,3-二甲基丁烷 |
| C、3-甲基-2-丁烯 |
D、 1,4-二甲苯 1,4-二甲苯 |
下列叙述中正确的是( )
| A、非金属单质分子中一定含有非极性共价键 | ||||
| B、根据电离方程式:HCl=H++Cl-,判断HCl分子中存在离子键 | ||||
C、根据2C+SiO2
| ||||
| D、变化过程中化学键被破坏,不一定发生了化学变化 |
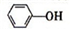 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子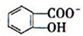 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)