题目内容
【题目】硫及其化合物有许多用途。相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________,基态S原子电子占据最高能级的电子云轮廓图为____________形。
(2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是____________。
(3)图(a)为S2的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为____________。
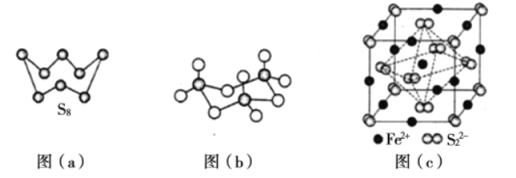
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为____________形,其中共价键的类型有____________种;固体三氧化硫中存在如图(b)所示的三聚分子。该分子中S原子的杂化轨道类型为____________。
(5) FeS2晶体的晶胞如图(c)所示,晶胞边长为a nm, FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为____________g·cm-3;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为____________nm。
【答案】 哑铃(纺锤) H2S S8、SO2都分子晶体,S8相对分子质量大于SO2,S8分子间范德华力强;熔沸点S8大于SO2 平面正三角 2 sp3
哑铃(纺锤) H2S S8、SO2都分子晶体,S8相对分子质量大于SO2,S8分子间范德华力强;熔沸点S8大于SO2 平面正三角 2 sp3 ![]()
![]()
【解析】
⑴基态Fe原子价层电子为其3d、4s能级上电子,基态S原子电子占据的能级有1s、2s、2p、3s、3p,最高能级为3p,其电子云轮廓图为哑铃形。
⑵H2S中S原子价层电子对个数= ![]() ,SO2中S原子价层电子对个数=
,SO2中S原子价层电子对个数= ![]() 、SO3中S原子价层电子对个数=
、SO3中S原子价层电子对个数=![]() 。
。
⑶S8、SO2都分子晶体,分子晶体熔沸点与其分子间作用力成正比,分子间作用力与其相对分子质量成正比;
⑷SO3中S原子价层电子对个数=![]() ,且不含孤电子对,根据价层电子对互斥理论判断其空间构型;该分子中S—O原子之间存在共价键;该分子中每个S原子价层电子对个数都是4,根据价层电子对互斥理论判断S原子杂化类型。
,且不含孤电子对,根据价层电子对互斥理论判断其空间构型;该分子中S—O原子之间存在共价键;该分子中每个S原子价层电子对个数都是4,根据价层电子对互斥理论判断S原子杂化类型。
⑸晶胞边长为anm=a×10-7cm,晶胞体积=(a×10-7cm)3,该晶胞中Fe2+个数=![]() ,S22-个数=
,S22-个数=![]() ,根据密度公式进行计算;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长根据正方形对角线的长度计算。
,根据密度公式进行计算;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长根据正方形对角线的长度计算。
(1)基态Fe原子的核外价电子排布式为[Ar]3d64s2,基态Fe原子价层电子为其3d、4s能级上电子,则基态Fe原子的核外价电子排布图为 ;基态s原子电子占据的能级有1s、2s、2p、3s、3p,最高能级为3p,其电子云轮廓图为哑铃(纺锤)形;故答案为:
;基态s原子电子占据的能级有1s、2s、2p、3s、3p,最高能级为3p,其电子云轮廓图为哑铃(纺锤)形;故答案为: ;哑铃(纺锤)。
;哑铃(纺锤)。
(2) H2S中S原子价层电子对个数= ![]() ,SO2中S原子价层电子对个数=
,SO2中S原子价层电子对个数= ![]() 、SO3中S原子价层电子对个数=
、SO3中S原子价层电子对个数=![]() ,中心原子价层电子对数不同于其他分子的是H2S;故答案为:H2S。
,中心原子价层电子对数不同于其他分子的是H2S;故答案为:H2S。
(3)S8、SO2都分子晶体,分子晶体熔沸点与其分子间作用力成正比,分子间作用力与其相对分子质量成正比,S8相对分子质量大于SO2,所以分子间作用力S8大于SO2,导致熔沸点S8大于SO2;故答案为:S8、SO2都分子晶体,S8相对分子质量大于SO2,S8分子间范德华力强;熔沸点S8大于SO2。
(4) SO3中S原子价层电子对个数=![]() ,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面正三角形;该分子中S—O原子之间存在σ和离域大π键,所以共价键类型2种;该分子中每个S原子价层电子对个数都是4,根据价层电子对互斥理论判断S原子杂化类型为sp3;故答案为:平面正三角;2;sp3。
,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面正三角形;该分子中S—O原子之间存在σ和离域大π键,所以共价键类型2种;该分子中每个S原子价层电子对个数都是4,根据价层电子对互斥理论判断S原子杂化类型为sp3;故答案为:平面正三角;2;sp3。
(5)晶胞边长为anm=a×107cm,晶胞体积=(a×107cm)3,该晶胞中Fe2+个数=![]() ,S22-个数=
,S22-个数=![]() ,其晶体密度
,其晶体密度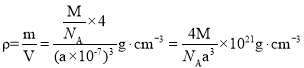 ;晶胞中Fe2+位于S22所形成的八面体的体心,该正八面体的边长为立方体面对角线长度的一半,因此正八面体的边长为
;晶胞中Fe2+位于S22所形成的八面体的体心,该正八面体的边长为立方体面对角线长度的一半,因此正八面体的边长为![]() nm;故答案为:
nm;故答案为:![]() ;
;![]() 。
。

 53随堂测系列答案
53随堂测系列答案【题目】中国制造彰显中国力量,在电影《厉害了,我的国》中重点介绍了中国制造的重点工程,下列所涉及的材料不属于无机非金属材料的是( )
世界最大射电望远镜“中国天眼” |
“嫦娥四号”月球探测器 |
中国大飞机C919 |
中国第一艘深海载人潜水器“蛟龙号” |
A.光导纤维传输线 | B.晶体硅芯片 | C.新型铝锂合金机翼 | D.氮化硅陶瓷发动机 |
A.AB.BC.CD.D