题目内容
【题目】高温炼铜的反应之一为2CuFeS2+O2![]() Cu2S+2FeS+SO2。
Cu2S+2FeS+SO2。
(1)Cu+基态核外电子排布式为___________。
(2)Cu、Zn的第二电离能:I2(Cu)________(填“>”“<”或“=”)I2(Zn)。
(3)SO2分子中S原子的轨道杂化类型为________,分子的立体构型为________。
(4)[Cu(CH3CN)4]+是非常稳定的络合离子,配体中σ键和π键个数之比为________。
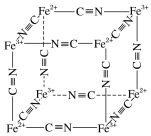
(5)Fe2+、Fe3+能与CN-络合,其结构如图所示。该离子可形成铁蓝钾盐,该钾盐的化学式为_________。
【答案】1s22s22p63s23p63d10(或[Ar]3d10) > sp2 V形 5∶2 KFeFe(CN)6或KFe[Fe(CN)6]
【解析】
(1)Cu是29号元素,其原子核外有29个电子,失去最外层4s能级上的一个电子生成Cu+,根据构造原理书写Cu+基态核外电子排布式;
(2)Zn的价电子排布式为3d104s2,Cu的价电子排布式为3d104s1,Cu失去一个电子内层达到饱和,再失去一个电子比较困难,Zn失去一个电子价层变为3d104s1,再失去一个电子比Cu+容易;
(3)SO2分子中S原子价层电子对个数![]() 且含有一个孤电子对,根据价层电子对互斥理论判断S原子的轨道杂化类型及分子的立体构型;
且含有一个孤电子对,根据价层电子对互斥理论判断S原子的轨道杂化类型及分子的立体构型;
(4)CH3CN中存在C-H单键、C-C单键和C≡N键,共价单键为σ键、共价三键中含有1个σ键和2个π键;
(5)该晶胞中Fe2+个数=Fe3+个数![]() ,CN-个数
,CN-个数![]() ,根据电荷守恒得K+个数
,根据电荷守恒得K+个数![]() ,则该晶胞中Fe2+、Fe3+、CN-、K+个数之比
,则该晶胞中Fe2+、Fe3+、CN-、K+个数之比![]() 。
。
(1)Cu是29号元素,其原子核外有29个电子,失去最外层4s能级上的一个电子生成Cu+,根据构造原理书写Cu+基态核外电子排布式为1s22s22p63s23p63d10(或[Ar]3d10),
故答案为:1s22s22p63s23p63d10(或[Ar]3d10);
(2)Zn的价电子排布式为3d104s2,Cu的价电子排布式为3d104s1,Cu失去一个电子内层达到饱和,再失去一个电子比较困难,Zn失去一个电子价层变为3d104s1,再失去一个电子比Cu+容易,所以Cu、Zn的第二电离能大小I2(Cu)>I2(Zn),
故答案为:>;
(3)SO2分子中S原子价层电子对个数![]() 且含有一个孤电子对,根据价层电子对互斥理论判断S原子的轨道杂化类型为sp2、分子的立体构型为V形;
且含有一个孤电子对,根据价层电子对互斥理论判断S原子的轨道杂化类型为sp2、分子的立体构型为V形;
故答案为:sp2;V形;
(4)CH3CN中存在CH单键、CC单键和C≡N键,共价单键为σ键、共价三键中含有1个σ键和2个π键,所以配体中σ键和π键个数之比为5:2,
故答案为:5:2;
(5) 该晶胞中Fe2+个数=Fe3+个数![]() ,CN-个数
,CN-个数![]() ,根据电荷守恒得K+个数
,根据电荷守恒得K+个数![]() ,则该晶胞中Fe2+、Fe3+、CN-、K+个数之比
,则该晶胞中Fe2+、Fe3+、CN-、K+个数之比![]() ,所以其化学式为KFeFe(CN)6或KFe[Fe(CN)6],
,所以其化学式为KFeFe(CN)6或KFe[Fe(CN)6],
故答案为:KFeFe(CN)6或KFe[Fe(CN)6]。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】硫及其化合物有许多用途。相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________,基态S原子电子占据最高能级的电子云轮廓图为____________形。
(2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是____________。
(3)图(a)为S2的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为____________。
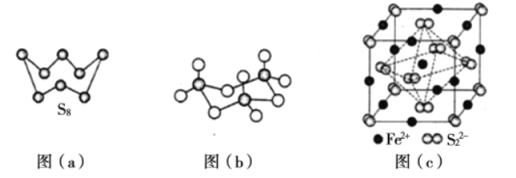
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为____________形,其中共价键的类型有____________种;固体三氧化硫中存在如图(b)所示的三聚分子。该分子中S原子的杂化轨道类型为____________。
(5) FeS2晶体的晶胞如图(c)所示,晶胞边长为a nm, FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为____________g·cm-3;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为____________nm。