��Ŀ����
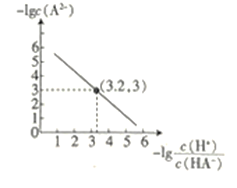
����Ŀ����ͼ��ʾ��������ƿ�зֱ����NO2���岢�ֱ������ʢ���������ʵ��ձ�(�ձ�����ˮ)�У���(1)�м���CaO����(2)�в��������κ����ʣ���(3)�м���NH4Cl���壬����(1)�к���ɫ���(3)�к���ɫ��dz��[��֪��Ӧ2NO2(����ɫ) N2O4(��ɫ)]
����������ȷ����(����)
A.2NO2N2O4�Ƿ��ȷ�Ӧ
B.NH4Cl����ˮʱ�ų�����
C.��ƿ(1)��ƽ���������ƽ����Է�����������
D.��ƿ(3)�������ѹǿ����
���𰸡�A
��������
2NO2(g)N2O4(g)��NO2Ϊ����ɫ���壬N2O4Ϊ��ɫ���壬������ɫ���˵��������NO2�ķ�����У�������ɫ��dz˵��������N2O4�ķ�����У���֪CaO��ˮ��Ӧ�����������Ƶķ�Ӧ�Ƿ��ȷ�Ӧ���ݴ˷�����1��ƿ�е������仯����3��ƿ����ɫ��dz��˵����Ӧ�����ƶ������ݷ���ʽ���ַ�Ӧ�����������С���ݴ˷�����3��ƿ��ѹǿ�仯�����
A.��1���к���ɫ���˵��ƽ�������淴Ӧ�����ƶ��ģ���CaO��ˮ��Ӧ�ų����������淴Ӧ���������ȷ�Ӧ��������Ӧ�����Ƿ��ȷ�Ӧ����A��ȷ��
B.��3���к���ɫ��dz��˵��ƽ�������ƶ�������Ӧ�Ƿ��ȷ�Ӧ�����Ȼ������ˮʱ������������B����
C.��1����ƽ�������ƶ���NO2��֮ǰ��Ⱥ������࣬����ϵ��ƽ����Է���������С����C����
D.��3���к���ɫ��dz��˵���Ȼ������ˮʱ����������ƽ�������ƶ�����������ʵ�����С������ƿ��3���е�ѹǿ��Ȼ��С����D����
��ѡA��

����Ŀ�����仯������������;��������ʵ��������������ʾ��
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
�۵�/�� | -85.5 | 115.2 | ��600(�ֽ�) | -75.5 | 16.8 | 10.3 |
�е�/�� | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
�ش��������⣺
��1����̬Feԭ�Ӽ۲���ӵĵ����Ų�ͼ���������ʽ��Ϊ____________����̬Sԭ�ӵ���ռ������ܼ��ĵ���������ͼΪ____________�Ρ�
��2�����ݼ۲���ӶԻ������ۣ�H2S��SO2��SO3����̬�����У�����ԭ�Ӽ۲���Ӷ�����ͬ���������ӵ���____________��
��3��ͼ��a��ΪS2�Ľṹ�����۵�ͷе�Ҫ�ȶ���������۵�ͷе�ߺܶ࣬��Ҫԭ��Ϊ____________��
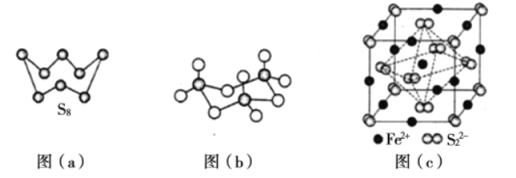
��4����̬���������Ե�������ʽ���ڣ�����ӵ����幹��Ϊ____________�Σ����й��ۼ���������____________�֣��������������д�����ͼ��b����ʾ�����۷��ӡ��÷�����Sԭ�ӵ��ӻ��������Ϊ____________��
��5�� FeS2����ľ�����ͼ��c����ʾ�������߳�Ϊa nm�� FeS2���ʽ��ΪM�������ӵ�������ֵΪNA���侧���ܶȵļ������ʽΪ____________g��cm��3��������Fe2+λ��S22�����γɵİ���������ģ�����������ı߳�Ϊ____________nm��
����Ŀ����������(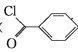 )���Ʊ�Ⱦ�ϣ�����ҩƷ����֬����Ҫ�м��壬�Թ������Ʊ��������ȵ�ԭ������(�÷�ӦΪ���ȷ�Ӧ)��
)���Ʊ�Ⱦ�ϣ�����ҩƷ����֬����Ҫ�м��壬�Թ������Ʊ��������ȵ�ԭ������(�÷�ӦΪ���ȷ�Ӧ)��
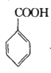 +COCl2
+COCl2![]()
![]() +CO2+HCl
+CO2+HCl
��֪�����������±���
���� | �۵�/�� | �е�/�� | �ܽ��� |
������ | 122.1 | 249 | ����ˮ���������Ҵ������ѵ��л��ܼ� |
̼����(COCl2) | -188 | 8.2 | �������ڱ����ױ��ȡ���ˮѸ��ˮ�⣬�����Ȼ��⣬�백�ܿ췴Ӧ����Ҫ��������[CO(NH2)2]���Ȼ�淋������� |
�������� | -1 | 197 | �������ѡ��ȷºͱ�����ˮ���Ҵ��ֽ⣬���ɱ���������������Ȼ��� |
���ȼ���(CHCl3) | -63.5 | 63.1 | ������ˮ�����ڴ����������ӷ����ȶ��Բ450�����Ϸ����ȷֽ� |
I.�Ʊ�̼����
��Ӧԭ����2 CHCl3��O2![]() 2HCl��COCl2
2HCl��COCl2
��.  ��.
��.  ��.
��.  ��.
��. ��.
��. 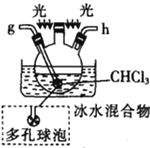
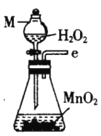
(1)����M��������____________
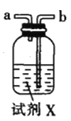
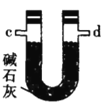
(2)�������������ҵ�˳��Ϊ___________��c��d��_________��_________��_________��_________��_________.
(3)�Լ�X��_______________(������)��
(4)װ�����м�ʯ�ҵ�������____________��
(5)װ�����б�ˮ������������____________��������ݵ�������________________��
��.�Ʊ���������(���ּг�װ��ʡ��)
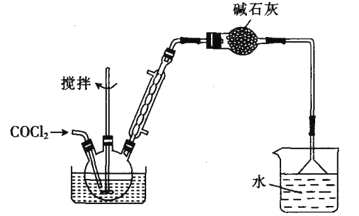
(6)̼����Ҳ������Ũ��ˮ���գ�д���÷�Ӧ�Ļ�ѧ����ʽ��______________��
����������ƿ�м���610g�����ᣬ�ȼ�����140~150�棬��ͨ��COCl2����ַ�Ӧ������Ʒ����ѹ����õ�562g�������ȣ������ת����Ϊ_________________��