题目内容
【题目】某澄清透明溶液可能含有Na+、Cl-、CO32-、SO42-、Mg2+、NH4+中的几种,进行如下实验:将上述溶液分为两等份,其中一份滴加足量的BaCl2溶液,得到白色沉淀4.66g;另一份溶液中滴加足量的NaOH溶液,得到0.58g白色沉淀,加热后产生标准状况下的气体0.224L,该气体能使湿润的红色石蕊试纸变蓝色。下列说法正确的是( )
A.溶液中可能有Na+、Cl-
B.溶液中一定没有Cl-、CO32-
C.溶液中一定有Na+、SO42-、Mg2+、NH4+
D.溶液中是否存在Na+只能用焰色反应确认
【答案】C
【解析】
一份溶液中滴加足量的NaOH溶液,得到0.58g白色沉淀,白色沉淀为氢氧化镁,溶液中Mg2+且物质的量为![]() =0.01mol,加热后产生标准状况下的气体0.224L,气体为氨气,溶液中含有NH4+且物质的量为
=0.01mol,加热后产生标准状况下的气体0.224L,气体为氨气,溶液中含有NH4+且物质的量为![]() =0.01mol,根据离子共存原则,有镁离子,肯定不含有CO32;一份滴加足量的BaCl2溶液,得到4.66g白色沉淀为硫酸钡,溶液中含有SO42且物质的量为
=0.01mol,根据离子共存原则,有镁离子,肯定不含有CO32;一份滴加足量的BaCl2溶液,得到4.66g白色沉淀为硫酸钡,溶液中含有SO42且物质的量为![]() =0.02mol,假设取液后的溶液体积为1L,c(Mg2+)=0.01mol/L,c(NH4+)=0.01 mol/L,c(SO42)=0.02 mol/L,根据电荷守恒,2c(Mg2+)+ c(NH4+)+ c(Na+)= 2c(SO42),溶液中一定含有阳离子Na+,不一定含有Cl,由上分析知,溶液中一定有Na+、SO42、Mg2+、NH4+,一定没有CO32,不确定有Cl,答案选C。
=0.02mol,假设取液后的溶液体积为1L,c(Mg2+)=0.01mol/L,c(NH4+)=0.01 mol/L,c(SO42)=0.02 mol/L,根据电荷守恒,2c(Mg2+)+ c(NH4+)+ c(Na+)= 2c(SO42),溶液中一定含有阳离子Na+,不一定含有Cl,由上分析知,溶液中一定有Na+、SO42、Mg2+、NH4+,一定没有CO32,不确定有Cl,答案选C。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)⑤和⑧的元素符号是_______和_______。
(2)元素①的最高价氧化物的电子式是_________________,元素①的某种烃A分子的球棍模型为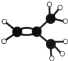 ,则A分子中最多有______个原子共平面。
,则A分子中最多有______个原子共平面。
(3)元素⑦和⑨的最高价氧化物的水化物反应的离子方程式为:____________________。
(4)请用化学方程式表示比较⑦、⑩单质氧化性的强弱:_________________。