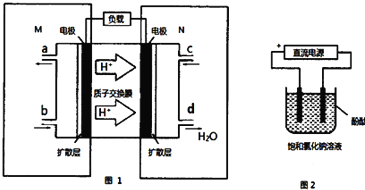
题目内容
19.恒温恒压的密闭容器中发生反应A(g)+2B(g)?3C(g),能说明反应达到平衡状态的是( )| A. | 容器内的压强不再变化 | |
| B. | 混合气体的密度不再变化 | |
| C. | 单位时间消耗2molA,同时消耗6molC | |
| D. | 混合气体的平均相对分子质量不再变化 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.该反应是在恒压条件下进行,则无论反应是否达到平衡状态,压强始终不变,所以不能根据压强判断平衡状态,故A错误;
B.该反应前后气体物质的量之和不变,所以恒温恒压条件下该容器体积不变,混合气体质量不变,所以密度始终不变,则不能根据密度判断平衡状态,故B错误;
C.单位时间消耗2molA,同时消耗6molC,同时生成2molA,正逆反应速率相等,该反应达到平衡状态,故C正确;
D.反应前后混合气体物质的量不变,混合气体质量始终不变,则混合气体平均相对分子质量都不变,所以不能据此判断平衡状态,故D错误;
故选C.
点评 本题考查化学平衡状态判断,为高频考点,只有反应前后改变的物理量才能作为平衡状态判断依据,为易错题.

练习册系列答案
相关题目
9.食用油和油中含有的主要成分属于( )
| A. | 糖类 | B. | 维生素 | C. | 无机盐 | D. | 油脂 |
14.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 1mol氯化钙溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为1mol/L | |
| B. | 在标准状况下,11.2LH2O所含的氢原子数为NA | |
| C. | CO2的摩尔质量为44g | |
| D. | 标准状况下22.4LCH4与l8gH2O所含有的电子数均为10NA |
4. 如图是甲、乙、丙、丁四种物质的转化关系,其中每一步都能一步实现的是( )
如图是甲、乙、丙、丁四种物质的转化关系,其中每一步都能一步实现的是( )
 如图是甲、乙、丙、丁四种物质的转化关系,其中每一步都能一步实现的是( )
如图是甲、乙、丙、丁四种物质的转化关系,其中每一步都能一步实现的是( )| 甲 | 乙 | 丙 | 丁 | |
| A | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
| B | Cu | CuO | CuSO4 | CuCl2 |
| C | NO | HNO3 | NO2 | NH3 |
| D | Si | Na2SiO3 | SiO2 | SiF4 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
8.下列说法正确的是( )
| A. | 烃是指含有碳、氢元素的化合物 | |
| B. | 烷烃的特征反应是取代反应和氧化反应 | |
| C. | 乙烯聚合后的产物是混合物 | |
| D. | 乙烷与氯气取代后的产物一定是纯净物 |
9.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.0L1.0mo1•L-1的NaNO3水溶液中含有的氧原子数为3NA | |
| B. | 3.9gNa2O2晶体中阴阳离子总数为0.15NA | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
 .
.