题目内容
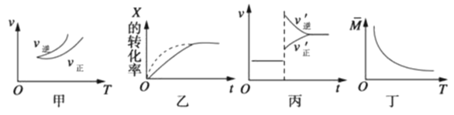
【题目】在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应:X(g)+ Y(g)![]() 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10-5 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的物质的量浓度减小
【答案】C
【解析】
A、2min内Y物质的量变化为0.16mol-0.12mol=0.04mol,故v(Y)= =0.002mol/(L·min),速率之比等于化学计量数之比,故v(Z)=2v(Y)=2×0.002mol/(L·min)=0.004mol/(L·min),故A错误;
=0.002mol/(L·min),速率之比等于化学计量数之比,故v(Z)=2v(Y)=2×0.002mol/(L·min)=0.004mol/(L·min),故A错误;
B、该反应正反应是放热反应,降低温度平衡向正反应移动,反应达到新平衡前v(逆)<v(正),故B错误;
C、由表中数据可知7min时,反应到达平衡,平衡时Y的物质的量为0.10mol,则:

由于反应前后气体的化学计量数相等,用物质的量代替浓度进行计算,故化学平衡常数k=![]() =1.44,故C正确;
=1.44,故C正确;
D、再通入0.2 mol Z,等效为在原平衡基础上增大压强,反应前后气体的体积不变,平衡不移动,X的体积分数不变,故D错误;
故选:C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目