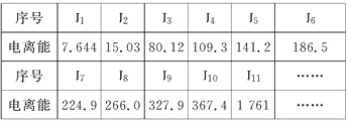
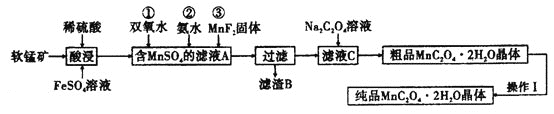
题目内容
【题目】![]() 是一种常见的化学试剂,是制备其他含锰化合物的重要原料。某课外化学兴趣小组利用软锰矿
是一种常见的化学试剂,是制备其他含锰化合物的重要原料。某课外化学兴趣小组利用软锰矿![]() 主要成分为
主要成分为![]() ,含少量
,含少量![]() 、
、![]() 和
和![]() 制备
制备![]() ,设计流程如图:
,设计流程如图:![]() 注:试剂①②③按编号顺序加入
注:试剂①②③按编号顺序加入![]()
已知:常温时部分难溶化合物的![]() 近似值
近似值![]() 如表:
如表:
物质 |
|
|
|
|
|
|
|
|
|
|
|
(1)该小组同学在酸浸之前,先将软锰矿粉碎,其目的是________。
(2)“酸浸”过程中![]() 发生反应的离子方程式为________。
发生反应的离子方程式为________。
(3)加入![]() 固体的作用是________,甲同学提出将上述流程中的氨水换成氢氧化钠溶液,乙同学觉得不妥,乙同学的理由是________。
固体的作用是________,甲同学提出将上述流程中的氨水换成氢氧化钠溶液,乙同学觉得不妥,乙同学的理由是________。
(4)丙同学认为向滤液C中滴加![]() 溶液的过程中可能会生成
溶液的过程中可能会生成![]() 沉淀,并提出可能的原因为
沉淀,并提出可能的原因为![]() ,常温时,该反应的平衡常数
,常温时,该反应的平衡常数![]() ________
________![]() 填数值
填数值![]() 。
。![]() 已知
已知![]() ,
,![]() 。
。
(5)操作Ⅰ的名称为________。
(6)如图是小组同学将![]() 晶体放在坩埚里加热分解时,固体失重质量分数随温度
晶体放在坩埚里加热分解时,固体失重质量分数随温度![]() 变化的曲线
变化的曲线![]() 已知草酸锰不稳定,但其中锰元素的化合价在
已知草酸锰不稳定,但其中锰元素的化合价在![]() 以下不变
以下不变![]() 。
。
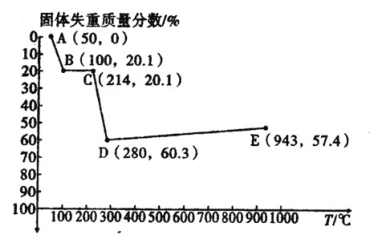
试根据各点的坐标![]() 近似值
近似值![]() 回答下列问题:
回答下列问题:
①![]() 的化学方程式为________。
的化学方程式为________。
②从D点到E点过程中固体失重的质量分数下降的原因是________。
【答案】增大反应物接触面积,加快化学反应速率,使反应物充分反应 ![]() 将
将![]() 转化为更难溶的
转化为更难溶的![]() 而除去
而除去![]() 或除去溶液中的
或除去溶液中的![]() 氢氧化钠溶液能进一步溶解
氢氧化钠溶液能进一步溶解![]() 沉淀,不易控制用量
沉淀,不易控制用量 ![]() 重结晶
重结晶 ![]()
![]() 与空气中的
与空气中的![]() 发生化合反应,生成新的锰的氧化物
发生化合反应,生成新的锰的氧化物
【解析】
用软锰矿(主要成分为MnO2,含少量![]() 、Fe2O3和A12O3等)制备
、Fe2O3和A12O3等)制备![]() :软锰矿用硫酸、硫酸亚铁溶解,酸性条件下二氧化锰被亚铁离子还原为Mn2+,滤液A中加入过氧化氢,将Fe2+氧化为Fe3+,加入氨水调节溶液pH,将Fe3+、Al3+转化为Fe(OH)3、Al(OH)3除去,再加入MnF2沉淀钙离子,过滤分离,滤渣中含有氢氧化铁、氢氧化铝和氟化钙,滤液C中加入草酸钠反应生成草酸锰然后分离提纯得到纯净的草酸锰晶体,据此分析解答。
:软锰矿用硫酸、硫酸亚铁溶解,酸性条件下二氧化锰被亚铁离子还原为Mn2+,滤液A中加入过氧化氢,将Fe2+氧化为Fe3+,加入氨水调节溶液pH,将Fe3+、Al3+转化为Fe(OH)3、Al(OH)3除去,再加入MnF2沉淀钙离子,过滤分离,滤渣中含有氢氧化铁、氢氧化铝和氟化钙,滤液C中加入草酸钠反应生成草酸锰然后分离提纯得到纯净的草酸锰晶体,据此分析解答。
(1)将软锰矿粉碎能增大固体的表面积,增大固体的表面积可以使固体与溶液充分接触反应,加快反应速率,使反应物充分反应,故答案为:增大反应物接触面积,加快化学反应速率,使反应物充分反应;
(2)酸性条件下二氧化锰被亚铁离子还原为Mn2+,亚铁离子被氧化为铁离子,反应的离子方程式为:MnO2+2Fe2++4H+ =Mn2++2Fe3++2H2O,故答案为:MnO2+2Fe2++4H+ =Mn2++2Fe3++2H2O;
(3)加入![]() 固体的作用是将
固体的作用是将![]() 转化为更难溶的
转化为更难溶的![]() 而除去
而除去![]() 或除去溶液中的
或除去溶液中的![]() ;氢氧化钠溶液能进一步溶解
;氢氧化钠溶液能进一步溶解![]() 沉淀,不易控制用量,因此甲同学提出将上述流程中的氨水换成氢氧化钠溶液,乙同学觉得不妥,故答案为:将
沉淀,不易控制用量,因此甲同学提出将上述流程中的氨水换成氢氧化钠溶液,乙同学觉得不妥,故答案为:将![]() 转化为更难溶的
转化为更难溶的![]() 而除去
而除去![]() 或除去溶液中的;氢氧化钠溶液能进一步溶解
或除去溶液中的;氢氧化钠溶液能进一步溶解![]() 沉淀,不易控制用量;
沉淀,不易控制用量;
(4)已知![]() ,
,![]() ,常温时,
,常温时,![]() 反应的平衡常数
反应的平衡常数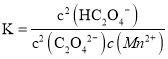 =
=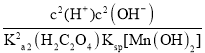 =
=![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
(5)操作Ⅰ是分离提纯![]() 粗品,所以该步骤的名称为重结晶,故答案为:重结晶;
粗品,所以该步骤的名称为重结晶,故答案为:重结晶;
(6)①MnC2O42H2O的摩尔质量为179g/mol,假设1molMnC2O42H2O发生分解,则C点失重:179g×0.201g≈36g,即恰好失去水分子,C点固体为MnC2O4,D点失重60.3%,则D点质量为:179g×(1-60.3%)≈71g,则D点为MnO,C~D的化学方程式为:MnC2O4 ![]() MnO+CO↑+CO2↑,故答案为:MnC2O4
MnO+CO↑+CO2↑,故答案为:MnC2O4 ![]() MnO+CO↑+CO2↑;
MnO+CO↑+CO2↑;
②由于MnO与空气中氧气发生化合反应生成新的锰的氧化物,导致从D到E点过程中固体失重的质量分数下降,故答案为:MnO与空气中O2发生化合反应,生成新的锰的氧化物。

【题目】钒钢具有高强度、弹性优良、抗磨损、抗冲击等性能,可用于汽车和飞机制造。一种从石煤(含SiO2、V2O3、V2O5和少量Fe2O3)中提取V2O5的流程如下图所示:
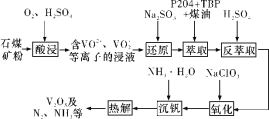
已知:
VO2+ | VO2+ | Fe2+ | Fe3+ | |
P2O4+TBP+煤油中的溶解度 | 很大 | 较小 | 0 | 很大 |
请回答下列问题:
(1)“酸浸”时,为提高浸出速率,除适当增加硫酸浓度、减小石煤矿粉粒径外,还可采取的措施有__________(任写一条);生成VO2+反应的离子方程式为_______。
(2)从整个流程来看,“还原”的目的为_______。
(3)实验室模拟“萃取”时,需用到的玻璃仪器有____________。
(4)“氧化”时发生反应的离子方程式为__________。
(5)上述流程中可以循环利用的物质有_________。
(6)全钒液流储能电池的工作原理为VO2++V3++H2O![]() VO2++V2++2H+。
VO2++V2++2H+。
①充电时,阳极的电极反应式为______;
②两极区被质子交换膜隔开,放电时,若外电路转移2mole-,则正极区溶液中n(H+)________(填“增加”或“减少”)________mol。