题目内容
【题目】常见物质之间的转化如下图所示:
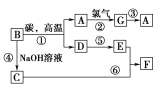
其中B常被用于制造光导纤维,其对应的单质的结构与金刚石的结构是相似的;C、F均含有A物质所含元素;反应中生成的水及次要产物均已略去。
(1)试推测:A________,C________,F________。(写化学式)
(2)试写出反应⑥的离子方程式:_________________________。
(3)在反应①中,碳的作用是____________________,当生成1 mol A时,转移电子的物质的量为________。
【答案】Si Na2SiO3 H2SiO3 SiO32-+CO2+H2O===CO32-+H2SiO3↓(或SiO32-+2CO2+2H2O===2HCO3-+H2SiO3↓) 作还原剂 4 mol
【解析】
B常被用于制造光导纤维,B是二氧化硅,其对应的单质的结构与金刚石的结构是相似的,二氧化硅高温下与碳反应生成CO和Si,则D是CO,A是硅,与氯气反应生成G是四氯化硅,四氯化硅被还原转化为硅。C、F均含有A物质所含元素,反应中生成的水及次要产物均已略去,因此B与氢氧化钠溶液反应生成的C是硅酸钠,硅酸钠与E反应生成F,则E是二氧化碳,F是硅酸沉淀,据此解答。
根据以上分析可知A是硅,B是二氧化硅,C是硅酸钠,D是CO,E是二氧化碳,F是硅酸,G是四氯化硅,则
(1)A、C、F的化学式分别是Si、Na2SiO3、H2SiO3;
(2)根据以上分析可知反应⑥的离子方程式为SiO32-+CO2+H2O=CO32-+H2SiO3↓或SiO32-+2CO2+2H2O=2HCO3-+H2SiO3↓;
(3)反应①的方程式为SiO2+2C![]() Si+2CO↑,碳元素化合价升高,失去电子,碳的作用是作还原剂。Si元素化合价从+4价降低到0价,因此当生成1 mol A时,转移电子的物质的量为4 mol。
Si+2CO↑,碳元素化合价升高,失去电子,碳的作用是作还原剂。Si元素化合价从+4价降低到0价,因此当生成1 mol A时,转移电子的物质的量为4 mol。

【题目】相关物质的溶度积常数见下表(25℃):
物质 | Mg(OH)2 | CH3COOAg | AgCl | Ag2CrO4 |
Ksp(单位略) | 1.1×10—11 | 2.3×10﹣3 | 1.8×10﹣10 | 1.9×10﹣12 |
下列有关说法中不正确的是
A. 浓度均为0.2 molL﹣1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀
B. 将0.001 molL﹣1的AgNO3溶液滴入0.001 molL﹣1的KCl和0.001 molL﹣1 的K2CrO4混合溶液中.先产生Ag2CrO4沉淀
C. 0.11 molL﹣1的MgCl2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9
D. 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变