题目内容
【题目】综合利用海水可以制备食盐、纯碱、金属镁等物质,其流程如图所示:
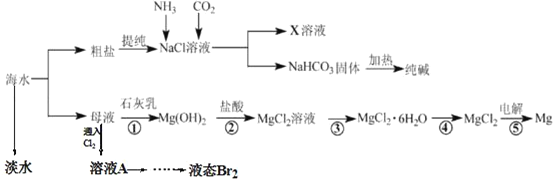
(1)从海水中获得淡水的装置如图,其中有_____处错误。

(2)在母液中通入氯气的离子方程式为_____,从溶液A中提取Br2,需要的主要仪器是____
(3)操作③是_____
(4)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质。
①为制得纯净的NaCl晶体,操作如下:
a.溶解;
b.依次加入过量的_____溶液、NaOH溶液、_____溶液;
c._____;
d.加适量盐酸;
e._____(请补全缺少的试剂和实验步骤)
②步骤b中,加入最后一种试剂发生反应的离子方程式为_____
(5)用这种方法制得的Na2CO3中有少量的NaCl,检验NaCl的实验为_____
【答案】3 2Br-+Cl2=Br2+2Cl- 分液漏斗 在氯化氢气流中蒸发浓缩、冷却结晶、过滤、洗涤、干燥 BaCl2 Na2CO3 过滤 蒸发(或蒸发结晶) CO32-+Ba2+=BaCO3↓、CO32-+Ca2+=CaCO3↓ 取少量样品于试管中,加入少量的水溶解,再滴加过量的硝酸酸化,再滴加硝酸银溶液,若有白色沉淀生成,则有NaCl
【解析】
将海水蒸发浓缩,冷却结晶得到粗盐和母液,向母液中加入氢氧化钙,过滤得到氢氧化镁沉淀,将沉淀溶于盐酸中发生反应,将溶液在氯化氢气流中蒸发浓缩,冷却结晶得到氯化镁水合物,将晶体在氯化氢氛围中加热得到固体氯化镁,电解熔融氯化镁得到镁;将粗盐提纯得到氯化钠溶液,向溶液中通入氨气和二氧化碳,生成碳酸氢钠和氯化铵,碳酸氢钠溶解度小于氯化钠而析出,所以得到溶液X为氯化铵溶液,将碳酸氢钠加热得到碳酸钠固体。
(1)烧瓶加热未垫石棉网,温度计水银球在蒸馏烧瓶支管口下方,冷凝管进水口在上,有3处错误。
(2)在母液中通入氯气发生氧化还原反应,离子方程式为2Br-+Cl2=Br2+2Cl-,从溶液A中提取Br2,需要的主要仪器是分液漏斗;
(3)操作③是氯化镁溶液中获得氯化镁晶体的过程,需要在氯化氢气流中蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(4)①为制得纯净的NaCl晶体,操作如下:首先要把粗盐溶于水形成溶液,然后镁离子用氢氧根离子沉淀,加入过量的氢氧化钠将镁离子沉淀,硫酸根用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,把过量的钡离子用碳酸根离子除去,沉淀完全除去后过滤,滤液加入盐酸除去溶液剩余的氢氧根离子和碳酸根离子,最后蒸发得到较纯净的氯化钠晶体。
②步骤b中,加入最后一种试剂发生反应的离子方程式为CO32-+Ba2+=BaCO3↓、CO32-+Ca2+=CaCO3↓;
(5)氯离子能和硝酸酸化的硝酸银溶液反应生成氯化银白色沉淀,所以检验纯碱样品中是否含有氯化钠应选用稀硝酸,硝酸银溶液,方法为取少量样品于试管中,加入少量的水溶解,再滴加过量的硝酸酸化,再滴加硝酸银溶液,若有白色沉淀生成,则有NaCl。

【题目】以黄铜矿(主要成分为 CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要工艺流程如下:
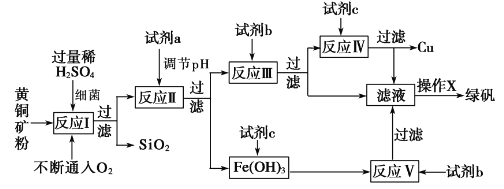
已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表。
沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 4.7 | 2.7 | 7.6 |
完全沉淀pH | 6.7 | 3.7 | 9.6 |
下列说法不正确的是
A. 试剂a可以是CuO或Cu(OH)2,作用是调节pH至3.7~4.7之间
B. 反应I的化学反应方程式为4 CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O,该反应中铁元素被还原
C. 操作X为蒸发浓缩至溶液表面出现晶膜,再冷却结晶
D. 反应Ⅲ的离子方程式为Cu2++Fe==Cu+Fe2+,试剂c参与反应的离子方程式分别为Fe+2H+=Fe2++H2↑,Fe(OH)3+3H+=Fe 3++3H2O
【题目】甲醇CH3OH)是一种重要的化工原料,工业上有多种方法可制得甲醇成品
(一)以CO、H2和CO2制备甲醇
①CO2(g)+H2(g)![]() COg)+H2O(g) H1
COg)+H2O(g) H1
②CO(g)+2H2 (g) ![]() CH3OH(g) △H2
CH3OH(g) △H2
③CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) H3
CH3OH(g)+H2O(g) H3
(1)已知:反应①的化学平衡常数K和温度的关系如下表
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
则下列说法正确的是______
A.反应①正反应是吸热反应
B.一定体积的密闭容器中,压强不再变化时,说明反应①达到平衡状态
C.1100℃时,反应①的K可能为1.5
D.在1000℃时,[c(CO2)·c(H2)]/[c(CO)·c(H2O)]约为0.59
(2)比较△H2_____△H3(填“>”、“=”或“<”)
(3)现利用②和③两个反应合成CH3OH,已知CO可使反应的催化剂寿命下降若氢碳比表示为f=[n(H2)-n(CO2)]/[n(CO)+n(CO2)],则理论上f=_____时,原料气的利用率高,但生产中住往采用略高于该值的氯碳比,理由是_________________________________.
(二)以天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2Og) ![]() CO(g)+3H2(g) H1>0
CO(g)+3H2(g) H1>0
(ii)合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) H2>0
CH3OH(g) H2>0
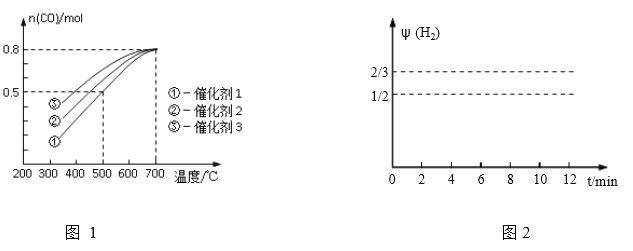
在一定压强下,1 mol CH4(g)和1 mol H2O(g)在三种不同催化剂作用下发生反应(i),经历相同时间时,CO的物质的量(n)随温度变化的关系如图1
(1)下列说法正确的是_______
A.曲线①中n(CO)随温度变化的原因是正反应为吸热反应,升高温度,平衡向右移动
B.三种催化剂中,催化剂③的催化效果最好,所以能获得最高的产率
C.当温度低于700℃时的曲线上的点可能都没有到达平衡
D.若温度大于700℃时,CO的物质的量保持不变
(2)500℃时,反应(1)在催化剂①的作用下到10mim时达到平衡,请在图2中画出反应(1)在此状态下0至12分钟内反应体系中H2的体积分数![]() (H2)随时间t变化的总趋势___________________
(H2)随时间t变化的总趋势___________________
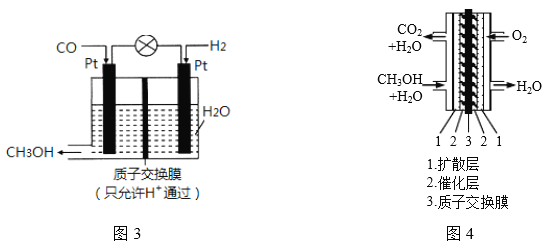
(三)研究表明,CO也可在酸性条件下通过电化学的方法制备甲醇,原理如图3所示。
(1)产生甲醇的电极反应式为___________________;
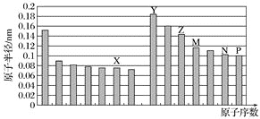
(2)甲醇燃料电池应用很广,其工作原理如图4,写出电池工作时的负极反应式:___________。