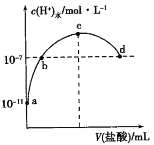
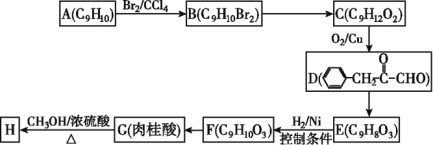
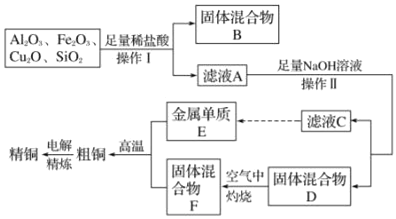
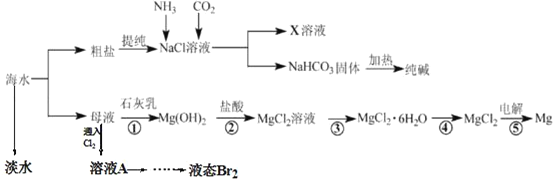
题目内容
【题目】某红色固体粉末可能是Cu、Cu2O、Fe2O3中的一种或几种。为探究其组成,称取a g该固体粉末样品,用过量的稀硫酸充分反应后(已知:Cu2O+2H+=Cu2++Cu+H2O),称得固体质量为b g。则下列推断不合理的是
A. 反应后溶液中大量存在的阳离子最多有3种
B. 向反应后的溶液中加入一定量的NaNO3,可能使b g固体完全溶解
C. 若b=![]() a,则红色固体粉末一定为纯净物
a,则红色固体粉末一定为纯净物
D. b的取值范围:0<b≤a
【答案】C
【解析】
根据题意红色固体粉末可能存在六种组成。
1、若a g红色固体粉末只有Cu,加入过量的稀硫酸不反应。称得固体质量b g即为铜的质量,因此b=a,此时溶液中只含有氢离子和硫酸根离子;
2、若a g红色固体粉末为Cu和Fe2O3的混合物,加入过量的稀硫酸与Cu不反应,与Fe2O3反应生成硫酸铁溶液,铜和硫酸铁溶液发生氧化还原反应:Cu + 2Fe3+ == Cu2+ + 2Fe2+,若称得固体质量b g即为原混合物中铜反应后剩余的质量,因此b<a,此时溶液中含有氢离子和硫酸根离子、二价铁离子和铜离子;
3、若a g红色固体粉末为Cu和Cu2O,依据Cu2O在酸性溶液中会发生反应:Cu2O+2H+═Cu+Cu2++H2O分析可知,加入过量的稀硫酸生成铜和硫酸铜溶液,称得固体质量b g即为原样品中的铜的质量加上Cu2O反应生成的铜的质量,因此b<a,此时溶液中只含有氢离子、硫酸根离子和铜离子;
4、若a g红色固体粉末只有Fe2O3,加入过量的稀硫酸与Fe2O3反应生成硫酸铁溶液,反应后无固体剩余,因此b=0,此时溶液中只含有氢离子和硫酸根离子;
5、若a g红色固体粉末只有Cu2O,依据Cu2O在酸性溶液中会发生反应:Cu2O+2H+═Cu+Cu2++H2O分析可知,加入过量的稀硫酸生成铜和硫酸铜溶液,称得固体质量b g即为Cu2O反应生成的铜的质量,因此b<a,此时溶液中只含有氢离子、硫酸根离子和铜离子;
6、若a g红色固体粉末为Cu2O和Fe2O3,加入过量的稀硫酸与Fe2O3反应生成硫酸铁溶液,与Cu2O反应生成铜和硫酸铜溶液,铜和硫酸铁溶液发生氧化还原反应:Cu + 2Fe3+ == Cu2+ + 2Fe2+,若称得固体质量b g即为Cu2O反应生成的铜再次反应后剩余的质量,因此b<a,此时溶液中含有氢离子以及硫酸根离子、铜离子、二价铁离子;
A. 根据上述分析,反应后溶液中大量存在的阳离子最多有3种,故A正确。
B. 不论以何种形式组成的红色固体,反应后若有固体剩余,一定是铜。由于硫酸过量,向反应后的溶液中加入一定量的NaNO3,形成硝酸,具有氧化性,可与铜反应,只要硝酸足够,可能使反应产生的固体完全溶解,故B正确
C. 若b=![]() a,即b<a,根据上述分析,红色固体粉末可能的组合为Cu和Fe2O3的混合物;Cu和Cu2O的混合物;只有Cu2O;Cu2O和Fe2O3的混合物,因此红色固体粉末可能是混合物也可以是纯净物,故C错误;
a,即b<a,根据上述分析,红色固体粉末可能的组合为Cu和Fe2O3的混合物;Cu和Cu2O的混合物;只有Cu2O;Cu2O和Fe2O3的混合物,因此红色固体粉末可能是混合物也可以是纯净物,故C错误;
D. 根据上述六种红色固体粉末组成的分析,b的取值范围:0<b≤a,故D正确。
答案选C。

【题目】将一定量的SO2(g)和O2(g)通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到下表中的两组数据:下列说法正确的是( )
实验 编号 | 温度/℃ | 平衡常数 /mol﹣1L | 起始量/mol | 平衡量/mol | ||
SO2 | O2 | SO2 | O2 | |||
1 | T1 | K1 | 4 | 2 | x | 0.8 |
2 | T2 | K2 | 4 | 2 | 0.4 | y |
A. x=2.4,y=0.2 B. T1、T2的大小:T1<T2
C. K1、K2的大小:K1<K2 D. T1℃时,若起始量增倍,K1>K2
【题目】高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表:
组分 | SiO2 | MgO | Na2O | K2O | Fe2O3 |
质量分数/% | 59.20 | 38.80 | 0.25 | 0.50 | 0.8 |
通过下图流程可由蛇纹石制备较纯净的二氧化硅。
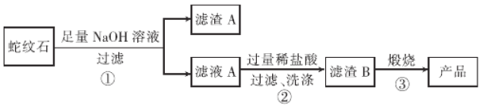
(1)蛇纹石中涉及的可溶性金属氧化物有____________(写化学式)。
(2)步骤①中涉及SiO2反应的离子方程式为________________。
(3)滤渣A 的成分有______________________(填化学式)。
(4)步骤②中洗涤沉淀的方法是_____________________。
(5)步骤③反应的化学方程式为______________________;实验室进行步骤③需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、和________________。