题目内容
【题目】下列说法正确的是( )


A. 图①中ΔH1=ΔH2+ΔH3
B. 图②在催化剂条件下,反应的活化能等于E1+E2
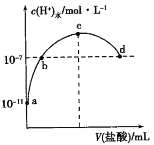
C. 图③表示醋酸溶液滴定 NaOH溶液和氨水混合溶液的电导率变化曲线
D. 图④可表示由CO(g)生成CO2(g)的过程中要放出566 kJ 热量
【答案】C
【解析】
试题根据盖斯定律来可知:一个反应无论是一步完成还是分为数步完成,其热效应是相同的,故应有:△H1=-△H2-△H3,A错误;E1、E2分别代表反应过程中各步反应的活化能,整个反应的活化能为能量较高的E1,B错误;氢氧化钠是强电解质,氨水是弱电解质,滴加的弱电解质先和氢氧化钠反应生成强电解质醋酸钠,但溶液体积不断增大,溶液被稀释,所以电导率下降;当氢氧化钠完全被中和后,醋酸继续与弱电解质氨水反应生成强电解质醋酸铵,所以电导率增大;氨水也完全反应后,继续滴加醋酸,因为溶液被稀释,电导率有下降趋势,C正确;图象中未标明CO、氧气以及CO2的物质的量与焓变的值的数值计量关系,D错误。

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目