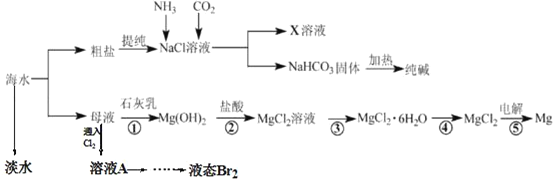
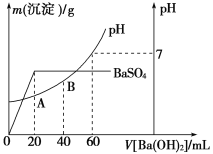
题目内容
【题目】聚合物G可用于生产全生物降解塑料,在“白色污染”日益严重的今天有着重要的作用。有关转化关系如下:
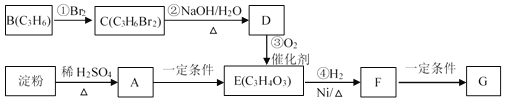
已知:CH3CH2CH2Br + NaOH![]() CH3CH2CH2OH + NaBr
CH3CH2CH2OH + NaBr
请回答下列问题:
(1)物质A的分子式为_______,B的结构简式为_______;
(2)请写出F中含氧官能团的名称_______;
(3)反应①~④中属于加成反应的是_______;
(4)写出由F生成聚合物G的化学方程式_______。
【答案】C6H12O6 CH3—CH=CH2 羟基、羧基 ①④ 
【解析】
根据上述路程图可知,B为丙烯,与溴发生加成反应生成1,2—二溴丙烷,1,2—二溴丙烷与NaOH溶液发生取代反应生成1,2—丙二醇,1,2—丙二醇经过催化氧化生成HOOC—CO—CH3,HOOC—CO—CH3与氢气发生加成反应生成CH3CH(OH)COOH,CH3CH(OH)COOH在一定条件下发生聚合反应生成G,另外淀粉水解生成葡萄糖,葡萄糖在一定条件下生成HOOC—CO—CH3
(1)物质A是葡萄糖,葡萄糖的分子式为C6H12O6,B的结构简式为CH3—CH=CH2;
(2)F是CH3CH(OH)COOH,含氧官能团的名称是羟基、羧基;
(3)反应①—④中属于加成反应的是①④;
(4)由F生成聚合物G的化学方程式为 。
。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表:
组分 | SiO2 | MgO | Na2O | K2O | Fe2O3 |
质量分数/% | 59.20 | 38.80 | 0.25 | 0.50 | 0.8 |
通过下图流程可由蛇纹石制备较纯净的二氧化硅。
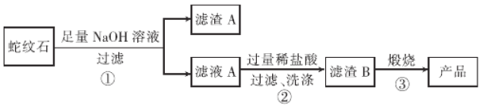
(1)蛇纹石中涉及的可溶性金属氧化物有____________(写化学式)。
(2)步骤①中涉及SiO2反应的离子方程式为________________。
(3)滤渣A 的成分有______________________(填化学式)。
(4)步骤②中洗涤沉淀的方法是_____________________。
(5)步骤③反应的化学方程式为______________________;实验室进行步骤③需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、和________________。
【题目】(一)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于____晶体,SeO2中Se原子采取的杂化类型为___。
(二)A、X、Y、Z、W、M、G等原子序数一次增大的前四周期元素
元素 | 相关信息 |
A | 原子核外电子总数与其周期数相同 |
X | 其羞态原子的L层中有3个未成对电子 |
Y | 荃态原子的2p轨道上有一个电子的自旋方向与2p轨道上其它电子的自旋方向相反 |
Z | 原子核外p电子数比s电子数多l个 |
W | 原子的第一至第四电离能(kJ·mol-1)分别是:I1=578,I2=1817 I3=2745 I4=11575 |
M | 元素的主族数与周期数相差4 |
G | 其基态原子最外层电子数为1,其余各电子层均充满电子 |
(1)画出W基态原子的核外电子排布图______。
(2)A2Y的VSEPR模型名称为____。
(3)已知为X2Y分子中Y原子只与一个X原子相连,请根据等电子原理,写出X2Y的电子式____。
(4)X、G形成的某种化合物的晶胞结构如图所示,则其化学式为______。

(5)已知Z和M形成的化合物的晶体密度为pg·cm-3,阿伏加德罗常效为NA,该晶体中两个距离最近的Z离子中心间距离为_____cm。