题目内容
【题目】甲醇CH3OH)是一种重要的化工原料,工业上有多种方法可制得甲醇成品
(一)以CO、H2和CO2制备甲醇
①CO2(g)+H2(g)![]() COg)+H2O(g) H1
COg)+H2O(g) H1
②CO(g)+2H2 (g) ![]() CH3OH(g) △H2
CH3OH(g) △H2
③CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) H3
CH3OH(g)+H2O(g) H3
(1)已知:反应①的化学平衡常数K和温度的关系如下表
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
则下列说法正确的是______
A.反应①正反应是吸热反应
B.一定体积的密闭容器中,压强不再变化时,说明反应①达到平衡状态
C.1100℃时,反应①的K可能为1.5
D.在1000℃时,[c(CO2)·c(H2)]/[c(CO)·c(H2O)]约为0.59
(2)比较△H2_____△H3(填“>”、“=”或“<”)
(3)现利用②和③两个反应合成CH3OH,已知CO可使反应的催化剂寿命下降若氢碳比表示为f=[n(H2)-n(CO2)]/[n(CO)+n(CO2)],则理论上f=_____时,原料气的利用率高,但生产中住往采用略高于该值的氯碳比,理由是_________________________________.
(二)以天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2Og) ![]() CO(g)+3H2(g) H1>0
CO(g)+3H2(g) H1>0
(ii)合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) H2>0
CH3OH(g) H2>0
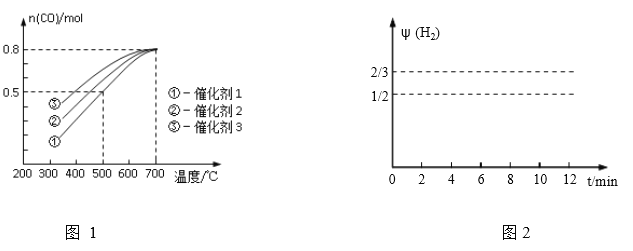
在一定压强下,1 mol CH4(g)和1 mol H2O(g)在三种不同催化剂作用下发生反应(i),经历相同时间时,CO的物质的量(n)随温度变化的关系如图1
(1)下列说法正确的是_______
A.曲线①中n(CO)随温度变化的原因是正反应为吸热反应,升高温度,平衡向右移动
B.三种催化剂中,催化剂③的催化效果最好,所以能获得最高的产率
C.当温度低于700℃时的曲线上的点可能都没有到达平衡
D.若温度大于700℃时,CO的物质的量保持不变
(2)500℃时,反应(1)在催化剂①的作用下到10mim时达到平衡,请在图2中画出反应(1)在此状态下0至12分钟内反应体系中H2的体积分数![]() (H2)随时间t变化的总趋势___________________
(H2)随时间t变化的总趋势___________________
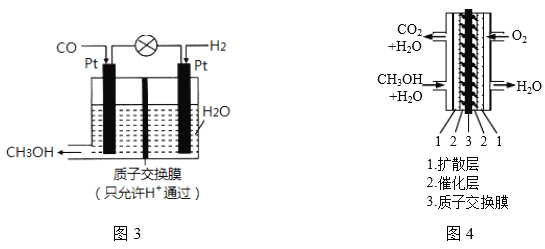
(三)研究表明,CO也可在酸性条件下通过电化学的方法制备甲醇,原理如图3所示。
(1)产生甲醇的电极反应式为___________________;
(2)甲醇燃料电池应用很广,其工作原理如图4,写出电池工作时的负极反应式:___________。
【答案】AD < 2 使CO充分反应,避免反应催化剂寿命下降 C 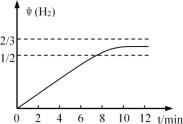 CO+4H++4 e-= CH3OH CH3OH+H2O-6e-=CO2+6H+
CO+4H++4 e-= CH3OH CH3OH+H2O-6e-=CO2+6H+
【解析】
(一)(1)根据表格数据,温度越高,平衡常数越大,说明反应向正反应移动,正反应为吸热,A正确;反应①CO2(g)+H2(g)![]() COg)+H2O(g)是反应前后气体体积不变的体系,压强不影响平衡移动,B错误;1000℃时K为1.7,温度越高,平衡常数越大,1100℃时K>1.7,C错误;在1000℃时,[c(CO2)·c(H2)]/[c(CO)·c(H2O)]为K的倒数,约为0.59,D正确;答案为AD。
COg)+H2O(g)是反应前后气体体积不变的体系,压强不影响平衡移动,B错误;1000℃时K为1.7,温度越高,平衡常数越大,1100℃时K>1.7,C错误;在1000℃时,[c(CO2)·c(H2)]/[c(CO)·c(H2O)]为K的倒数,约为0.59,D正确;答案为AD。
(2)随温度升高K1增大,说明反应①的正反应为吸热反应,△H1>0,盖斯定律计算得到△H3=△H1+△H2,则△H2<△H3。
(3)由①CO(g)+2H2(g)CH3OH(g) ②CO2(g)+3H2(g)CH3OH(g)+H2O(g)化学方程式可知![]() =2,原料气的利用率最高,但生产中往往采用略高于该值的氢碳比,理由:使CO充分反应,避免反应催化剂寿命下降,故答案为:2;使CO充分反应,避免反应催化剂寿命下降;
=2,原料气的利用率最高,但生产中往往采用略高于该值的氢碳比,理由:使CO充分反应,避免反应催化剂寿命下降,故答案为:2;使CO充分反应,避免反应催化剂寿命下降;
(二) (1)曲线①中n(CO)随温度升高而增大,反应逆向进行,正反应为放热,A错;催化剂③的使用时n(CO)变化量少,即CO转化率低,产率也不高,B错;当体系中各物质的物质的量保持不变时,反应平衡,根据图象,曲线上的点在不停地变化,反应没有达到平衡,C正确;温度大于700℃时,CO的物质的量曲线未画出,不一定保持不变,D错误。答案选C。
(2)根据图一中CO的物质的量曲线及反应中H2生成和消耗的计量关系,0至12分钟内反应体系中生成物H2的体积分数![]() (H2)随时间t变化的总趋势为
(H2)随时间t变化的总趋势为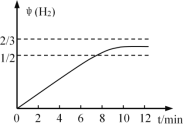
(三)(1)CO也可在酸性条件下通过电化学的方法制备甲醇,据图3可知,一氧化碳得电子生成甲醇,则产生甲醇的电极反应式为CO+4H++4 e-= CH3OH;
(2)据图4可知,正极上氧气得电子和氢离子反应生成水,电极反应式为:3O2+12H++12e=6H2O,负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为2CH3OH12e+2H2O=2CO2↑+12H+,故答案为:CH3OH6e+H2O=CO2↑+6H+;