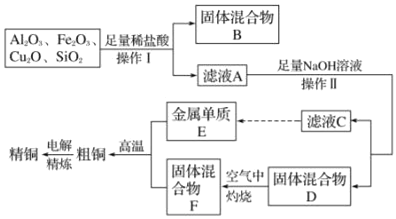
题目内容
【题目】以黄铜矿(主要成分为 CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要工艺流程如下:
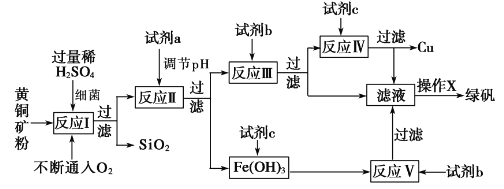
已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表。
沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 4.7 | 2.7 | 7.6 |
完全沉淀pH | 6.7 | 3.7 | 9.6 |
下列说法不正确的是
A. 试剂a可以是CuO或Cu(OH)2,作用是调节pH至3.7~4.7之间
B. 反应I的化学反应方程式为4 CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O,该反应中铁元素被还原
C. 操作X为蒸发浓缩至溶液表面出现晶膜,再冷却结晶
D. 反应Ⅲ的离子方程式为Cu2++Fe==Cu+Fe2+,试剂c参与反应的离子方程式分别为Fe+2H+=Fe2++H2↑,Fe(OH)3+3H+=Fe 3++3H2O
【答案】B
【解析】
A. 加入试剂a调节pH至3.7~4.7之间,目的是使Fe3+形成Fe(OH)3沉淀,同时要防止生成Cu(OH)2沉淀,为了防止引入新的杂质,试剂a可以是CuO[或Cu(OH)2、CuCO3等],故A正确;
B. 反应I的化学反应方程式为4 CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O,该反应中铁元素化合价升高被氧化,故B错误;
C. 操作X为从硫酸亚铁溶液中得到绿矾晶体,当蒸发浓缩至溶液表面出现晶膜时,再冷却结晶即可,故C正确;
D. 反应Ⅲ主要是Cu2+与过量的Fe(即b试剂)反应,为将Cu2+全部转化,加入的铁粉过量,因此在反应Ⅳ时应该将过量的铁粉除去,利用铁、铜的性质差别,加入适量稀硫酸(即试剂c)即可,参与反应的离子方程式分别为Fe+2H+=Fe2++H2↑,Fe(OH)3+3H+=Fe 3++3H2O,故D正确;
答案选B。

【题目】(一)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于____晶体,SeO2中Se原子采取的杂化类型为___。
(二)A、X、Y、Z、W、M、G等原子序数一次增大的前四周期元素
元素 | 相关信息 |
A | 原子核外电子总数与其周期数相同 |
X | 其羞态原子的L层中有3个未成对电子 |
Y | 荃态原子的2p轨道上有一个电子的自旋方向与2p轨道上其它电子的自旋方向相反 |
Z | 原子核外p电子数比s电子数多l个 |
W | 原子的第一至第四电离能(kJ·mol-1)分别是:I1=578,I2=1817 I3=2745 I4=11575 |
M | 元素的主族数与周期数相差4 |
G | 其基态原子最外层电子数为1,其余各电子层均充满电子 |
(1)画出W基态原子的核外电子排布图______。
(2)A2Y的VSEPR模型名称为____。
(3)已知为X2Y分子中Y原子只与一个X原子相连,请根据等电子原理,写出X2Y的电子式____。
(4)X、G形成的某种化合物的晶胞结构如图所示,则其化学式为______。

(5)已知Z和M形成的化合物的晶体密度为pg·cm-3,阿伏加德罗常效为NA,该晶体中两个距离最近的Z离子中心间距离为_____cm。