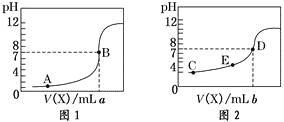
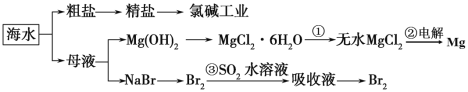
题目内容
【题目】重水(D2O)的离子积为1.6×10-15,可以用pH一样的定义来规定pD= -lg[D+],以下关于pD的叙述不正确的是( )
A.中性溶液的pD〉7.0
B.含0.01mol NaOD的D2O溶液1L,其pD=12.0
C.溶解0.01molDCl的D2O溶液1L,其pD=2.0
D.在100mL0.25mol/L的DCl重水溶液中,加入50mL0.2mol/LNaOD的重水溶液,其pD=1.0
【答案】B
【解析】
重水D2O中c(D+)=c(OD-),D2O的离子积![]() ,结合pD=-lgc(D+)计算判断;
,结合pD=-lgc(D+)计算判断;
A. 重水D2O中c(D+)=c(OD),呈中性,D2O的离子积![]() ,则c(D+)=4×108mol/L,pD=lgc(D+)═lg4×108=7.4,所以中性溶液的pD =7.4>7.0,A正确;
,则c(D+)=4×108mol/L,pD=lgc(D+)═lg4×108=7.4,所以中性溶液的pD =7.4>7.0,A正确;
B. 0.01mol/L的NaOD的D2O溶液中,c(OD)=0.01mol/L,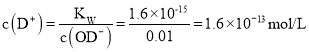 ,pD=lg1.6×1013=12.8, B错误;
,pD=lg1.6×1013=12.8, B错误;
C. 0.01mol/L的DCl的D2O溶液中c(D+)=0.01mol/L,pD=lg0.01=2.0,C正确;
D. 100mL0.25 molL1的DCl重水溶液和50mL0.2 molL1的NaOD的重水溶液混合时,DCl过量,所以 ,pD=1.0,D正确;
,pD=1.0,D正确;
答案选B。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目