题目内容
【题目】常温下,在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3-
B.含有大量Al3+的水溶液中:Na+、NH4+、HCO3-、Br-
C.![]() =0.1mol·L-1的溶液:Na+、K+、SO32-、NO3-
=0.1mol·L-1的溶液:Na+、K+、SO32-、NO3-
D.水电离产生的c(H+)为1×10-l2mol·L-1的溶液:AlO2-、Na+、Cl-、CO32-
【答案】C
【解析】
A.滴加甲基橙试剂显红色的溶液呈酸性,Fe2+、NO3在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.含有大量Al3+的水溶液,HCO3-与Al3+发生双水解而不能大量共存,故B错误;
C.![]() =0.1mol·L-1的溶液显碱性,Na+、K+、SO32-、NO3-之间及与OH-不发生反应,能大量共存,故C正确;
=0.1mol·L-1的溶液显碱性,Na+、K+、SO32-、NO3-之间及与OH-不发生反应,能大量共存,故C正确;
D.由水电离产生的c(H+)为1×10-12mol/L的溶液中水的电离被抑制,溶液可能显酸性,也可能显碱性,酸性条件下CO32-、AlO2-与H+不能大量共存,故D错误;
答案选C。

【题目】参考下列图表和有关要求回答问题:

(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E2的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:_________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:____________________________________。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能(kJ·mol-1) | 198 | 360 | 498 | x |
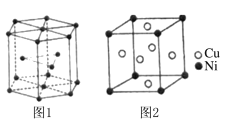
已知1 mol白磷(P4)完全燃烧放热为1194kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=________ kJ·mol-1
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理电池废料以节约资源、保护环境。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(由Al箔、LiFePO4活性材料、少量不溶于酸碱的导电剂组成)中的资源,部分流程如图:
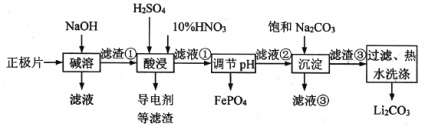
已知:Ksp(Li2CO3)=1.6×10-3。部分物质的溶解度(S)如表所示:
T/℃ | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g | S(LiH2PO4)/g |
20 | 1.33 | 34.2 | 0.039 | 126 |
80 | 0.85 | 30.5 | —— | —— |
(1)将回收的废旧锂离子电池进行预放电、拆分破碎、热处理等预处理,筛分后获得正极片。下列分析你认为合理的是__________。
A.废旧锂离子电池在处理之前需要进行彻底放电,否则在后续处理中,残余的能量会集中释放,可能会造成安全隐患。
B.预放电时电池中的锂离子移向负极,不利于提高正极片中锂元素的回收率。
C.热处理过程可以除去废旧锂离子电池中的难溶有机物、碳粉等。
(2)写出碱溶时主要发生反应的离子方程式:________。
(3)为提高酸浸的浸出率,除粉碎、搅拌、升温外,还可采用的方法有______。(写出一种即可)
(4)酸浸时产生标况下3.36 L NO时,溶解LiFePO4________mol(其他杂质不与HNO3反应)。
(5)若滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3后,沉淀中的Li元素占原Li元素总量的90%,计算滤液③中c(CO32-)=__________mol/L。
(6)流程中用“热水洗涤”的原因是________。
(7)工业上将回收的Li2CO3、FePO4粉碎与足量炭黑混合高温灼烧再生制备LiFePO4,写出反应的化学方程式:_________。