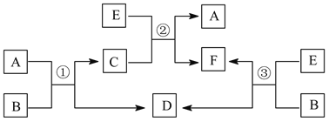
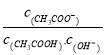题目内容
【题目】常温下,用 0.10 mol·L-1NaOH溶液分别滴定20.00 mL 0.10 mol·L-1HCl溶液和20.00 mL 0.10 mol·L-1CH3COOH溶液,得到2条滴定曲线,如下图所示,则下列说法正确的是
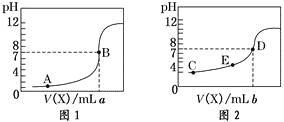
A.图2是滴定盐酸的曲线
B.a与b的关系是:a<b
C.E点对应离子浓度由大到小的顺序为: c(CH3COO-) >c(Na+) >c(H+) >c(OH-)
D.这两次滴定都可以用甲基橙作为指示剂且颜色变化为红变橙
【答案】C
【解析】
A.图2在开始滴定时溶液的pH=3,而盐酸是强酸,完全电离,0.10 mol·L-1HCl的pH=1,与实际情况不符合,所以这是滴定醋酸的曲线,A错误;
B.由于盐酸与醋酸的浓度相等,体积相同,则两种酸的物质的量相同,当滴定达到溶液d的pH=7时,由于醋酸钠水解可使溶液显碱性,故a与b的关系是:a>b,B错误;
C.在E点时溶液为酸性溶液,对应离子浓度由大到小的顺序为: c(CH3COO-)>c(Na+)>c(H+)>c(OH-),C正确;
D.用碱滴定酸时,为了减小滴定误差,应该选择溶液的颜色由浅到深的的变化的酚酞作指示剂,颜色变化为无色变红色,且醋酸的滴定终点溶液显碱性,D错误。
故选C。

【题目】参考下列图表和有关要求回答问题:

(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E2的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:_________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:____________________________________。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能(kJ·mol-1) | 198 | 360 | 498 | x |
已知1 mol白磷(P4)完全燃烧放热为1194kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=________ kJ·mol-1
【题目】氯气及其化合物在生产生活中有重要的应用。
(1)可用O2将HCl转化为Cl2:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。已知相关化学键的键能如下表所示
化学键 | H-Cl | O=O | Cl – Cl | H-O |
E(kJ·mol-1 | a | b | c | d |
则该反应的△H=______________。(用含a、b、c、d的代数式表示)
(2)氯气是有机合成中的重要试剂,丙烯(CH2=CHCH3)和Cl2在一定条件下发生如下反应: CH2=CHCH3 (g)+Cl2(g) ![]() CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
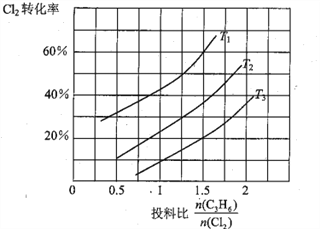
①该反应的△H______________0(填“>”或“<”)
②下列措施能增大丙烯的平衡转化率的是______________ (填标号)。
A.降低温度 B.减小容器的体积
C.使用新型催化剂 D.从容器中移走氯化氢
③T1时,在容积为5L的密闭容器中充入0.15mol丙烯和0.10 molCl2,10min时达到平衡,则v(Cl2)为______________mol·〔L·min)-1,平衡常数K为______________,保持温度不变,减小投料比![]() ,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
④上述反应在低于某温度时,CH2=CHCH2Cl的产率快速下降,可能的原因是____________________________。