题目内容
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A.c水(H+)=1×10-12 mol·L -1的溶液:Al3+、Fe3+、Cl-、SO42-
B.![]() =1×10-13mol·L -1的溶液:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L -1的溶液:NH4+、Ca2+、Cl-、NO3-
C.澄清透明的无色溶液:K+、NH4+、MnO4-、HCO3-
D.和Al反应放出H2的溶液:Mg2+、Cu2+、NO3-、SO42-
【答案】B
【解析】
A、c水(H+)=1×10-12mol·L -1的溶液可能呈酸性,也可能呈碱性;若溶液呈碱性,Al3+、Fe3+不能大量存在;A不符合题意;
B、![]() =1×10-13mol·L -1,则c(H+)=
=1×10-13mol·L -1,则c(H+)=![]() =0.1mol·L-1,则溶液呈酸性,该组离子可以大量共存,B符合题意;
=0.1mol·L-1,则溶液呈酸性,该组离子可以大量共存,B符合题意;
C、MnO4-呈紫色,与题中“无色”矛盾,C不符合题意;
D、和Al反应放出H2的溶液可能呈碱性,也可能呈酸性;若溶液呈酸性,Al和H+、NO3-反应不会放出H2,与题干矛盾,D不符合题意;
故选B。

 名校课堂系列答案
名校课堂系列答案【题目】氯气及其化合物在生产生活中有重要的应用。
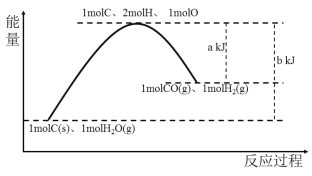
(1)可用O2将HCl转化为Cl2:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。已知相关化学键的键能如下表所示
化学键 | H-Cl | O=O | Cl – Cl | H-O |
E(kJ·mol-1 | a | b | c | d |
则该反应的△H=______________。(用含a、b、c、d的代数式表示)
(2)氯气是有机合成中的重要试剂,丙烯(CH2=CHCH3)和Cl2在一定条件下发生如下反应: CH2=CHCH3 (g)+Cl2(g) ![]() CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)

①该反应的△H______________0(填“>”或“<”)
②下列措施能增大丙烯的平衡转化率的是______________ (填标号)。
A.降低温度 B.减小容器的体积
C.使用新型催化剂 D.从容器中移走氯化氢
③T1时,在容积为5L的密闭容器中充入0.15mol丙烯和0.10 molCl2,10min时达到平衡,则v(Cl2)为______________mol·〔L·min)-1,平衡常数K为______________,保持温度不变,减小投料比![]() ,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
④上述反应在低于某温度时,CH2=CHCH2Cl的产率快速下降,可能的原因是____________________________。