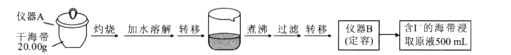
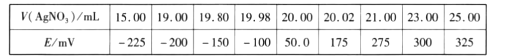
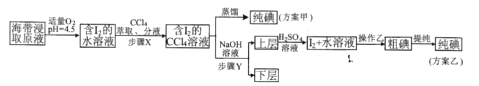
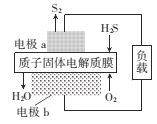
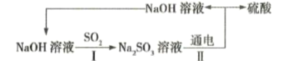
题目内容
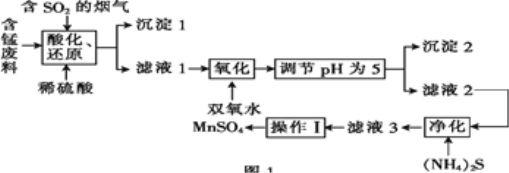
【题目】工业上用含锰废料(主要成分为MnO2,含有少量Fe2O3、Al2O3、CuO、CaO等)与烟气脱硫进行联合处理并制备MnSO4的流程如图所示:
已知:25℃时,部分氢氧化物的溶度积常数(Ksp)如表所示。
氢氧化物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
Ksp | 1.3×10-33 | 4.0×10-38 | 2.2×10-20 | 1.9×10-14 |
回答下列问题:
(1)沉淀1的化学式为____。
(2)室温下,调节pH为5。试通过计算说明此时Al3+、Fe3+已沉淀完全:____。
(3)(NH4)2S的电子式为____;“净化”时,加入(NH4)2S的作用为____。
(4)“酸化、还原”中,发生的所有氧化还原反应的离子方程式为____。
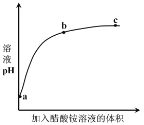
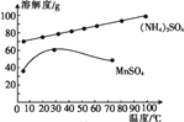
(5)已知:滤液3中除MnSO4外,还含有少量(NH4)2SO4。(NH4)2SO4、MnSO4的溶解度曲线如图所示。据此判断,“操作Ⅰ”应为蒸发浓缩、____、洗涤、干燥。
(6)工业上可用电解酸性MnSO4溶液的方法制备MnO2,其阳极反应式为____。
【答案】CaSO4 室温下,pH=5时,c(OH-)=10-9 mol·L-1,c(Fe3+)=![]() =
=![]() =4.0×10-11 mol·L-1,同理,c(Al3+)=1.3×10-6 mol·L-1,皆小于1.0×10-5 mol·L-1,故Al3+、Fe3+已沉淀完全
=4.0×10-11 mol·L-1,同理,c(Al3+)=1.3×10-6 mol·L-1,皆小于1.0×10-5 mol·L-1,故Al3+、Fe3+已沉淀完全 ![]() 使Cu2+转化为CuS沉淀 MnO2+SO2=Mn2++SO42-、Fe2O3+SO2+2H+=2Fe2++SO42-+H2O 趁热过滤 Mn2++2H2O-2e-=MnO2+4H+
使Cu2+转化为CuS沉淀 MnO2+SO2=Mn2++SO42-、Fe2O3+SO2+2H+=2Fe2++SO42-+H2O 趁热过滤 Mn2++2H2O-2e-=MnO2+4H+
【解析】
含锰废料(主要成分为MnO2,含有少量Fe2O3、Al2O3、CuO、CaO等)中加入稀硫酸和含SO2的烟气,能将酸化后所得锰还原为Mn2+,将Fe3+还原为Fe2+,同时将溶液中的Ca2+转化为CaSO4沉淀,即成为沉淀1的主要成分;往滤液中加入H2O2,可将Fe2+氧化为Fe3+;调节pH=5,此时c(OH-)=10-9 mol·L-1,利用Ksp,判断哪些阳离子转化为沉淀,从而得出沉淀2的成分;滤液2中加入(NH4)2S,与Cu2+反应生成CuS沉淀;过滤后,将滤液蒸发结晶,便可获得MnSO4晶体。
(1)由以上分析可知,沉淀1的化学式为CaSO4。答案为:CaSO4;
(2)室温下,调节pH为5,先求出溶液中的c(OH-),然后利用Ksp进行计算,若c(Al3+)、c(Fe3+)小于10-5mol/L,则表明沉淀完全。计算过程为:室温下,pH=5时,c(OH-)=10-9 mol·L-1,c(Fe3+)=![]() =
=![]() =4.0×10-11 mol·L-1,同理,c(Al3+)=1.3×10-6 mol·L-1,皆小于1.0×10-5 mol·L-1,故Al3+、Fe3+已沉淀完全。答案为:室温下,pH=5时,c(OH-)=10-9 mol·L-1,c(Fe3+)=
=4.0×10-11 mol·L-1,同理,c(Al3+)=1.3×10-6 mol·L-1,皆小于1.0×10-5 mol·L-1,故Al3+、Fe3+已沉淀完全。答案为:室温下,pH=5时,c(OH-)=10-9 mol·L-1,c(Fe3+)=![]() =
=![]() =4.
=4.
(3)(NH4)2S为离子化合物,由NH4+和S2-构成,电子式为![]() ;“净化”时,加入(NH4)2S的作用是使Cu2+转化为CuS沉淀。答案为:
;“净化”时,加入(NH4)2S的作用是使Cu2+转化为CuS沉淀。答案为:![]() ;使Cu2+转化为CuS沉淀;
;使Cu2+转化为CuS沉淀;
(4)“酸化、还原”中,含SO2的烟气,能将酸化后所得锰还原为Mn2+,将Fe3+还原为Fe2+,反应的离子方程式为MnO2+SO2=Mn2++SO42-、Fe2O3+SO2+2H+=2Fe2++SO42-+H2O。答案为:MnO2+SO2=Mn2++SO42-、Fe2O3+SO2+2H+=2Fe2++SO42-+H2O;
(5)从溶解度曲线看,蒸发后,MnSO4溶解度降低,会结晶析出,但若过滤过程中温度降低,也会导致(NH4)2SO4结晶析出,所以应注意温度的变化。据此判断,“操作Ⅰ”应为蒸发浓缩、趁热过滤、洗涤、干燥。答案为:趁热过滤;
(6)电解酸性MnSO4溶液时,Mn2+失电子的产物与水反应生成MnO2和H+,其阳极反应式为Mn2++2H2O-2e-=MnO2+4H+。答案为:Mn2++2H2O-2e- =MnO2+4H+。