题目内容
【题目】下列描述中正确的是( )
A. 氮原子的价电子排布图:![]()
B. 2p和3p轨道形状均为哑铃形,能量也相等
C. 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
D. 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态
【答案】C
【解析】
试题A.由洪特规则可知,电子优先占据1个轨道,且自旋方向相同;
B.3p轨道的能量大于2p轨道的能量;
C.价电子排布为4s24p3的元素有4个电子层、最外层电子数为5,最后填充p电子;
D.原子由基态变成激发态需要吸收能量.
解:A.根据“洪特规则”可知,2p轨道电子的自旋方向应该相同,正确的电子排布图为:![]() ,故A错误;
,故A错误;
B.2p和3p轨道形状均为哑铃形,但是原子轨道离原子核越远,能量越高,2p轨道能量低于3p,故B错误;
C.价电子排布为4s24p3的元素有4个电子层、最外层电子数为5,位于第四周期第ⅤA族,最后填充p电子,是p区元素,故C正确;
D.基态Na的电子排布式为1s22s22p63s1,由基态转化成激发态1s22s22p63p1时,电子能量增大,需要吸收能量,故D错误;
故选C.

【题目】工业上用含锰废料(主要成分为MnO2,含有少量Fe2O3、Al2O3、CuO、CaO等)与烟气脱硫进行联合处理并制备MnSO4的流程如图所示:
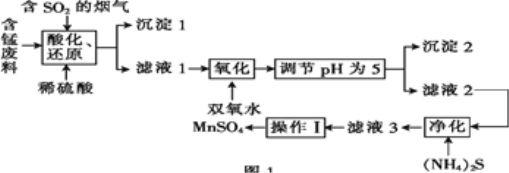
已知:25℃时,部分氢氧化物的溶度积常数(Ksp)如表所示。
氢氧化物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
Ksp | 1.3×10-33 | 4.0×10-38 | 2.2×10-20 | 1.9×10-14 |
回答下列问题:
(1)沉淀1的化学式为____。
(2)室温下,调节pH为5。试通过计算说明此时Al3+、Fe3+已沉淀完全:____。
(3)(NH4)2S的电子式为____;“净化”时,加入(NH4)2S的作用为____。
(4)“酸化、还原”中,发生的所有氧化还原反应的离子方程式为____。
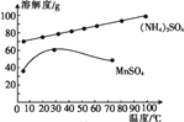
(5)已知:滤液3中除MnSO4外,还含有少量(NH4)2SO4。(NH4)2SO4、MnSO4的溶解度曲线如图所示。据此判断,“操作Ⅰ”应为蒸发浓缩、____、洗涤、干燥。
(6)工业上可用电解酸性MnSO4溶液的方法制备MnO2,其阳极反应式为____。