题目内容
【题目】判断下列粒子的空间构型
(1)CO2:_______________________
(2)H2S:____________
(3)SO2:___________
(4)NH4+:_________________
(5)CO32-:_____________
【答案】 直线形 V形 V形 正四面体形 平面三角形
【解析】用价层电子对互斥理论判断,CO2为直线形,H2S为V形,SO2为V形,NH4+为正四面体形,CO32-为平面三角形。
(1)CO2中中心原子C上的孤电子对数为![]() (4-2
(4-2![]() 2)=0,成键电子对数为2,价层电子对数为0+2=2,VSEPR模型为直线形,C原子没有孤电子对,CO2为直线形。
2)=0,成键电子对数为2,价层电子对数为0+2=2,VSEPR模型为直线形,C原子没有孤电子对,CO2为直线形。
(2)H2S中中心原子S上的孤电子对数为![]() (6-2
(6-2![]() 1)=2,成键电子对数为2,价层电子对数为2+2=4,VSEPR模型为四面体形,略去S原子上的两对孤电子对,H2S为V形。
1)=2,成键电子对数为2,价层电子对数为2+2=4,VSEPR模型为四面体形,略去S原子上的两对孤电子对,H2S为V形。
(3)SO2中中心原子S上的孤电子对数为![]() (6-2
(6-2![]() 2)=1,成键电子对数为2,价层电子对数为1+2=3,VSEPR模型为平面三角形,略去S原子上的一对孤电子对,SO2为V形。
2)=1,成键电子对数为2,价层电子对数为1+2=3,VSEPR模型为平面三角形,略去S原子上的一对孤电子对,SO2为V形。
(4)NH4+中中心原子N上的孤电子对数为![]() (5-1-4
(5-1-4![]() 1)=0,成键电子对数为4,价层电子对数为0+4=4,VSEPR模型为正四面体形,N原子没有孤电子对,NH4+为正四面体形。
1)=0,成键电子对数为4,价层电子对数为0+4=4,VSEPR模型为正四面体形,N原子没有孤电子对,NH4+为正四面体形。
(5)CO32-中中心原子C上的孤电子对数为![]() (4+2-3
(4+2-3![]() 2)=0,成键电子对数为3,价层电子对数为0+3=3,VSEPR模型为平面三角形,C原子没有孤电子对,CO32-为平面三角形。
2)=0,成键电子对数为3,价层电子对数为0+3=3,VSEPR模型为平面三角形,C原子没有孤电子对,CO32-为平面三角形。

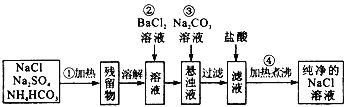
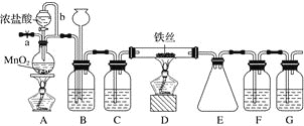
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中的化学反应方程式是________________(锰被还原为Mn2+)。
②C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有__________________(写离子方程式)。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否为K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
Ⅰ.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由____________________________________产生(用离子方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________。
②根据K2FeO4的制备实验得出:氧化性Cl2________FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________。
【题目】下表为元素周期表的一部分,表中列出12种元素在周期表中的位置,按要求回答下列各题:
周期族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ⑦ | ⑨ | ||||||
3 | ② | ④ | ⑥ | ⑧ | ⑩ | |||
4 | ③ | ⑤ |
(1)这12种元素中,化学性质最不活泼的元素是______(填元素符号或化学式,下同),得电子能力最强的原子是______,失电子能力最强的单质与水反应的离子反应方程式是____,常温下单质为液态的非金属单质是____________。
(2)元素⑤的离子结构示意图为__________________。
(3)写出⑦⑧⑨与①形成的简单化合物中最稳定的分子式________。写出⑧⑩两种元素最高价氧化物对应水化物中酸性较弱的化学式________。
(4)写出⑨⑩与①形成的化合物中沸点最低的化学式______酸性最强的化学式_______。
(5)写出④的单质置换出⑦的单质的化学反应方程式:__________________。
②和⑥两种元素最高价氧化物对应的水化物相互反应的离子方程式为__________。
③和⑩两种元素最高价氧化物对应的水化物相互反应的离子方程式为__________。
用电子式表示⑤与⑨组成的二元化合物的形成过程_____________________。