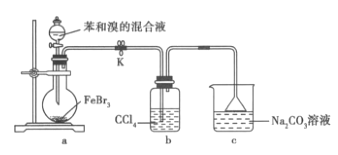
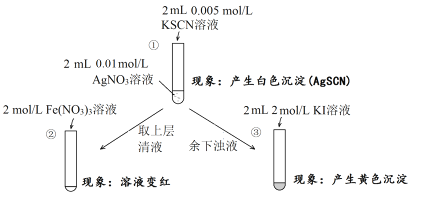
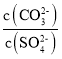题目内容
【题目】室温下,向 0.01 mol·L-1 的醋酸溶液中滴入 pH=7 的醋酸铵溶液,溶液 pH 随滴入醋酸铵溶液体积变化的曲线示意图如图所示。下列分析正确的是
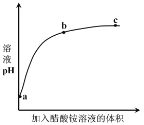
A.a点,pH = 2
B.b点,c(CH3COO-) > c(NH4+)
C.c点,pH可能大于7
D.ac段,pH的增大仅是因为醋酸电离平衡逆向移动
【答案】B
【解析】
A.由于醋酸是弱电解质,不能完全电离,所以0.01mol/的醋酸溶液中氢离子浓度小于 0.01mol/L,a点的pH大于2,A 错误;
B.所得溶液为CH3COOH和CH3COONH4 的混合溶液,CH3COONH4溶液显中性,CH3COOH溶液显酸性,所以 b 点溶液中c(H+)>c(OH﹣),根据电荷守恒可知 c(CH3COO﹣)>c(NH4+),B正确;
C.酸性的CH3COOH溶液中加入中性的CH3COONH4溶液,所得混合溶液必显酸性,即 c 点溶液的 pH 一定小于 7,C错误;
D.ac 段溶液的pH增大,不仅是因为醋酸的电离平衡逆向移动,还有溶液的稀释作用,D错误;
故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
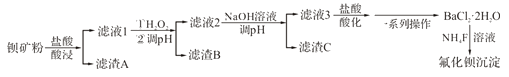
小学生10分钟应用题系列答案【题目】工业上用含锰废料(主要成分为MnO2,含有少量Fe2O3、Al2O3、CuO、CaO等)与烟气脱硫进行联合处理并制备MnSO4的流程如图所示:
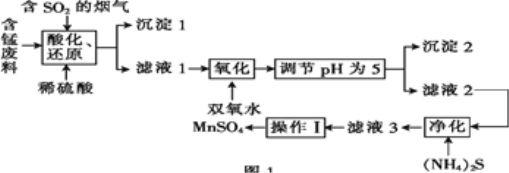
已知:25℃时,部分氢氧化物的溶度积常数(Ksp)如表所示。
氢氧化物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
Ksp | 1.3×10-33 | 4.0×10-38 | 2.2×10-20 | 1.9×10-14 |
回答下列问题:
(1)沉淀1的化学式为____。
(2)室温下,调节pH为5。试通过计算说明此时Al3+、Fe3+已沉淀完全:____。
(3)(NH4)2S的电子式为____;“净化”时,加入(NH4)2S的作用为____。
(4)“酸化、还原”中,发生的所有氧化还原反应的离子方程式为____。
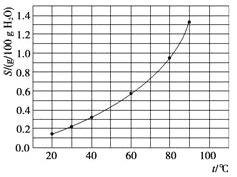
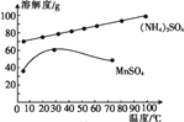
(5)已知:滤液3中除MnSO4外,还含有少量(NH4)2SO4。(NH4)2SO4、MnSO4的溶解度曲线如图所示。据此判断,“操作Ⅰ”应为蒸发浓缩、____、洗涤、干燥。
(6)工业上可用电解酸性MnSO4溶液的方法制备MnO2,其阳极反应式为____。
【题目】相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g) + 3H2(g) ![]() 2NH3(g)△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量a kJ |
② | 2 | 3 | 0 | 放出热量b kJ |
③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是
A. 放出热量关系:a < b <92.4
B. 三个容器内反应的平衡常数:③>①>②
C. 达平衡时氨气的体积分数:①>③
D. N2的转化率:②>①>③