题目内容
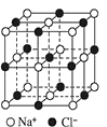
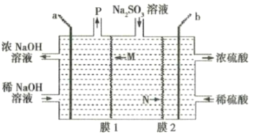
【题目】处理烟气中的![]() 可以采用碱吸——电解法,其流程如左图:模拟过程Ⅱ如图,下列推断正确的是( )
可以采用碱吸——电解法,其流程如左图:模拟过程Ⅱ如图,下列推断正确的是( )

A.膜1为阴离子交换膜,膜2为阳离子交换膜
B.若用锌锰碱性电池为电源,a极与锌极相连
C.a极的电极反应式为![]()
D.若收集![]() 的P(标准状况下),则转移
的P(标准状况下),则转移![]() 电子
电子
【答案】B
【解析】
由流程图可知,碱吸-电解法处理SO2,最终将SO2转变成硫酸,同时也使碱液再生,重复利用;电解时,S发生变价由亚硫酸根转变为硫酸根;因此,电解池中生成硫酸的极室中发生的是亚硫酸根被氧化的反应,所以b电极为阳极,a电极则为阴极;进一步可知,膜1即阳离子交换膜,允许亚硫酸钠溶液中的Na+转移至阴极区;膜2为阴离子交换膜,允许亚硫酸钠溶液中的亚硫酸根转移至阳极区。
A.通过分析可知,膜1为阳离子交换膜,膜2为阴离子交换膜,A项错误;
B.通过分析可知,电解池中a电极为阴极,应该与外电源的负极相接,而锌锰碱性电池中锌电极为负极,B项正确;
C.通过分析可知,a电极为阴极,发生的是还原反应,电极反应式为:![]() ,C项错误;
,C项错误;
D.通过分析可知,P即为氢气,若要收集标况下22.4L的氢气,则需要转移2mol电子,D项错误;
答案选B。

【题目】工业上用含锰废料(主要成分为MnO2,含有少量Fe2O3、Al2O3、CuO、CaO等)与烟气脱硫进行联合处理并制备MnSO4的流程如图所示:
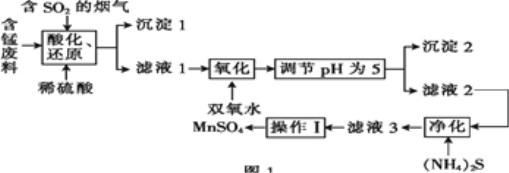
已知:25℃时,部分氢氧化物的溶度积常数(Ksp)如表所示。
氢氧化物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
Ksp | 1.3×10-33 | 4.0×10-38 | 2.2×10-20 | 1.9×10-14 |
回答下列问题:
(1)沉淀1的化学式为____。
(2)室温下,调节pH为5。试通过计算说明此时Al3+、Fe3+已沉淀完全:____。
(3)(NH4)2S的电子式为____;“净化”时,加入(NH4)2S的作用为____。
(4)“酸化、还原”中,发生的所有氧化还原反应的离子方程式为____。
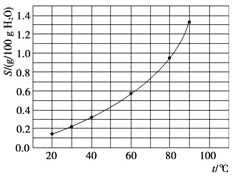
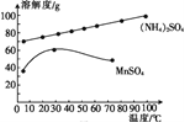
(5)已知:滤液3中除MnSO4外,还含有少量(NH4)2SO4。(NH4)2SO4、MnSO4的溶解度曲线如图所示。据此判断,“操作Ⅰ”应为蒸发浓缩、____、洗涤、干燥。
(6)工业上可用电解酸性MnSO4溶液的方法制备MnO2,其阳极反应式为____。