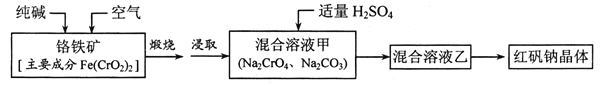
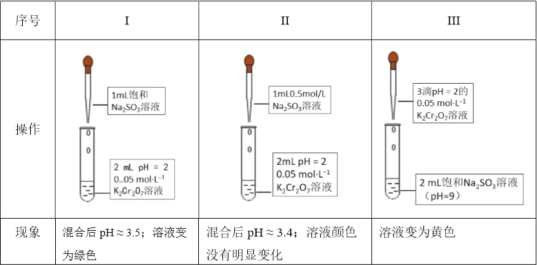
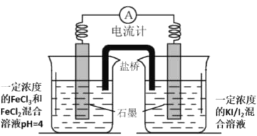
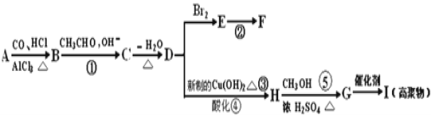
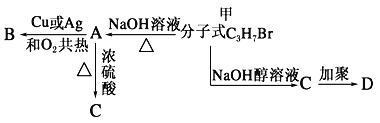
题目内容
【题目】某无色溶液X,由Na+、Ag+、Ba2+、Al3+、Fe3+、AlO2﹣、CO32﹣、SO42﹣中的若干种离子组成,取该溶液进行如下实验:
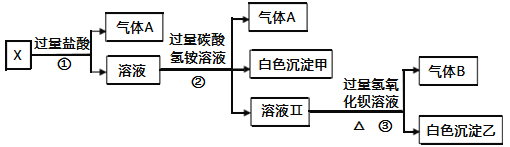
(1)气体A的成分是________(填化学式,下同),气体B的成分是________。
(2)写出步骤①发生反应的所有离子方程式________________________。
(3)写出步骤②形成白色沉淀甲的离子方程式________________________。
(4)通过上述实验,可确定X溶液中一定存在的离子是________,尚未确定是否存在的离子是________,只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是________________________________________________________。
【答案】CO2 NH3 CO3+2H+=H2O+CO2 ↑ AlO2-+4H+=Al3++2H2O Al3++3HCO3-=Al(OH)3↓+3CO2 ↑ Na+、CO32-、AlO2- SO42- 向所得沉淀乙中滴加足量的稀硝酸,若沉淀不完全溶解,则证明含有SO42﹣
【解析】
溶液X为无色溶液,即X中一定不含有Fe3+,Ag+与AlO2-、CO32-、SO42-不能大量共存,Ba2+与CO32-、SO42-不能大量共存,Al3+与AlO2-、CO32-不能大量共存,根据反应①,产生气体A,气体A只能为CO2,X溶液中一定含有CO32-,即X溶液一定不含有Al3+、Ag+、Ba2+,反应①中加入盐酸过量,反应②中加入过量的NH4HCO3,产生的气体为CO2,白色沉淀甲只能为Al(OH)3,则X溶液中一定含有AlO2-,碳酸氢铵过量,与过量Ba(OH)2反应,并加热,得到气体为NH3,白色沉淀乙一定含有BaCO3,可能含有BaSO4,据此分析即可;
溶液X为无色溶液,即X中一定不含有Fe3+,Ag+与AlO2-、CO32-、SO42-不能大量共存,Ba2+与CO32-、SO42-不能大量共存,Al3+与AlO2-、CO32-不能大量共存,根据反应①,产生气体A,气体A只能为CO2,X溶液中一定含有CO32-,即X溶液一定不含有Al3+、Ag+、Ba2+,反应①中加入盐酸过量,反应②中加入过量的NH4HCO3,产生的气体为CO2,白色沉淀甲只能为Al(OH)3,则X溶液中一定含有AlO2-,碳酸氢铵过量,与过量Ba(OH)2反应,并加热,得到气体为NH3,白色沉淀乙一定含有BaCO3,可能含有BaSO4,
(1)根据上述分析,气体A为CO2,气体B为NH3;
(2)反应①中发生离子方程式为2H++CO32-=CO2↑+H2O、AlO2-+4H+=Al3++2H2O;
(3)Al3+与HCO3-发生双水解反应,其离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)根据上述分析,X溶液中一定含有的离子是AlO2-、CO32-,一定不含有的离子是Ba2+、Al3+、Ag+、Fe3+,可能含有的离子是SO42-,根据溶液呈现电中性,推出X溶液中一定含有Na+,即X中一定含有的离子是AlO2-、CO32-、Na+;白色沉淀乙一定含有BaCO3,可能含有BaSO4,BaCO3溶于硝酸,BaSO4不溶于硝酸,因此检验是否存在SO42-,需要向所得沉淀乙中滴加足量的稀硝酸,若沉淀不完全溶解,则证明含有SO42-。

【题目】海水中蕴藏着丰富的资源,海水综合利用的流程图如下:

(一)某化学研究小组用如图装置模拟步骤I电解食盐水(用铁和石墨做电极)。

(1)a电极材料是_____(填铁、石墨),其电极反应式为_________。
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为______(忽略反应前后溶液体积的变化)。
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+。
下表是生成氢氧化物沉淀的pH:
物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,可选用的物质是_____(填序号,下同),加入_____调节溶液的pH,充分反应后过滤,可得MgCl2溶液。
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2·H2O获得MgCl2的操作是:_________。
(三)制取工业溴:
(5)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是_______。
(6)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式:________。