题目内容
3.下列溶液中的氯离子数目、浓度与50mL 1mol•L-1的FeCl3溶液中氯离子数目、浓度相等的是( )| A. | 50mL 1.5mol•L-1的CaCl2溶液 | B. | 100mL 3mol•L-1的NH4Cl溶液 | ||
| C. | 75mL 3mol•L-1的KCl溶液 | D. | 50mL 2mol•L-1的FeCl2溶液 |
分析 50mL 1mol•L-1的FeCl3溶液中氯离子物质的量为0.05L×1mol/L×3=0.15mol,溶液中离子的物质的量相等,则离子数目一定相等,根据n=c•V结合化合物的组成计算;根据化学式可知1mol•L-1的FeCl3溶液中氯离子浓度为3mol/L,结合各选项中化学式判断溶液中氯离子浓度,注意离子的浓度与溶液的体积无关,与物质的构成有关.
解答 解:50mL 1mol•L-1的FeCl3溶液中氯离子物质的量为0.05L×1mol/L×3=0.15mol,氯离子浓度是3mol/L.
A、50mL 1.5mol•L-1的CaCl2溶液中氯离子物质的量为0.05L×1.5mol/L×2=0.15mol,氯离子浓度是3mol/L,故A正确;
B、100mL 3mol•L-1的NH4Cl溶液中氯离子物质的量为0.1L×3mol/L=0.3mol,氯离子浓度是3mol/L,故B错误;
C、75mL3mol•L-1的KCl溶液中氯离子物质的量为0.075L×3mol/L=0.225mol,氯离子浓度是3mol/L,故C错误;
D、50mL2mol•L-1的FeCl2溶液中氯离子物质的量为0.05L×2mol/L×2=0.2mol,氯离子浓度是4mol/L,故D错误.
故选A.
点评 本题考查物质的量浓度的计算,明确物质的构成是解答本题的关键,题目难度不大,注意物质的量与质量、浓度等物理量的计算公式的运算、离子的浓度与溶液的体积无关,与物质的构成有关.

练习册系列答案
相关题目
16.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如图1:
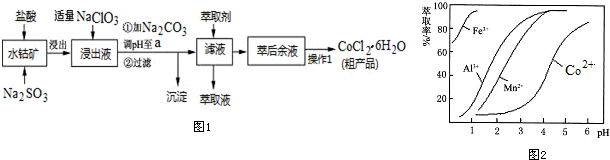
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5.
11.下列溶液中导电性最强的是( )
| A. | 1 L 0.1 mol/L醋酸 | B. | 0.1 L 0.1 mol/L H3PO4溶液 | ||
| C. | 0.5 L 0.1 mol/L盐酸 | D. | 2 L 0.1 mol/L H2SO3溶液 |
18.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):根据以上规律判断,上列结论正确的是( )
| A. | 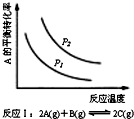 反应Ⅰ:△H>0,P2>P1 | B. | 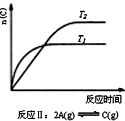 反应Ⅱ:△H<0,T1<T2 | ||
| C. | 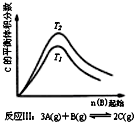 反应Ⅲ:△H<0,T2>T1;或△H>0,T2<T1 | D. | 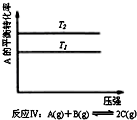 反应Ⅳ:△H<0,T2<T1或△H>0,T2>T1 |
15.对下列装置或操作描述正确的是( )


| A. | 图①用于实验室制乙烯 | |
| B. | 图②用于实验室制乙炔并验证乙炔可以发生氧化反应 | |
| C. | 图③用于实验室中分馏石油 | |
| D. | 图④中若A为醋酸,B为贝壳,C为苯酚钠溶液,则可验证醋酸的酸性大于碳酸,但不能验证碳酸的酸性大于苯酚 |
12.NA代表阿伏伽德罗常数,下列说法正确的是( )
| A. | 标准状况下,1L乙醇完全燃烧产生CO2分子的数目为$\frac{{N}_{A}}{22.4}$×2 | |
| B. | 磷酸的摩尔质量与NA个磷酸分子的质量之和相等 | |
| C. | 16gO2、O3的混合物所含的氧原子数目为NA | |
| D. | 1molOH-所含的质子数为10NA |
13.下列各组物质中符合“酸、碱、盐、酸性氧化物”顺序的是( )
| A. | H2SO4、Na2O、MgCl2、CO2 | B. | NaHCO3、Ba(OH)2、Na2CO3、ZnO | ||
| C. | HNO3、Ca(OH)2、Na2CO3、SO3 | D. | HCl、KOH、Na2CO3、MgO |
 分子式为C3H7Br的有机物甲在适宜的条件下能发生如下一系列转化:
分子式为C3H7Br的有机物甲在适宜的条件下能发生如下一系列转化: .
.