题目内容
13.Ⅰ:“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图1所示的装置制取乙酸乙酯.回答下列问题: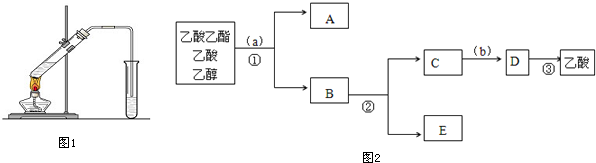
(1)浓硫酸的作用是:①催化剂;②吸水剂
(2)现拟分离乙酸乙酯、乙酸、乙醇的混合物,图2是分离操作流程图.完成下列空白:
试剂:a饱和Na2CO3溶液,b硫酸.分离方法:①分液③蒸馏
物质名称:A乙酸乙酯,C乙酸钠
Ⅱ:已知卤代烃(R-X)在碱性条件下可水解得到醇(R-OH),
如:CH3CH2-X+H2O $→_{NaOH}^{△}$ CH3CH2-OH+HR,现有如下转化关系:
 $\stackrel{反应1}{→}$X$\stackrel{反应2}{→}$Y$\stackrel{反应3}{→}$
$\stackrel{反应1}{→}$X$\stackrel{反应2}{→}$Y$\stackrel{反应3}{→}$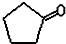
回答下列问题:
(1)反应1的条件为光照,X的结构简式为
(2)写出反应3的方程式
 .
.Ⅲ:写出苹果酸
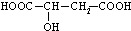
①和乙醇完全酯化的反应的化学方程式2CH3CH2OH+HOOC-CHOH-CH2COOH
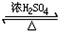 CH3CH2OOC-CHOH-CH2COOCH2CH3+2H2O
CH3CH2OOC-CHOH-CH2COOCH2CH3+2H2O②和过量的Na2CO3溶液反应的化学方程式HOOC-CH(OH)-CH2-COOH+2Na2CO3→NaOOC-CH(OH)-CH2-COONa+2NaHCO3.
分析 Ⅰ:(1)乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
(2)分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸;
Ⅱ:根据烃和氯气在光照条件下发生取代反应生成氯代烃,氯代烃能水解生成醇,醇能氧化生成醛或酮分析;
Ⅲ:有机物苹果酸中含有2个-COOH和1个-OH,可与乙醇发生酯化反应,可与过量的碳酸钠反应生成碳酸氢钠.
解答 解:Ⅰ:(1)乙酸与乙醇发生酯化反应,该反应为可逆反应,需浓硫酸作催化剂,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,故浓硫酸的作用为催化剂、吸水剂,
故答案为:催化剂;吸水剂;
(2)乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离;分离油层和水层采用分液的方法即可;对水层中的乙酸钠和乙醇进一步分离时应采取蒸馏操作分离出乙醇;然后水层中的乙酸钠,根据强酸制弱酸,要用硫酸反应得到乙酸,再蒸馏得到乙酸,
故答案为:饱和Na2CO3溶液;硫酸;分液;蒸馏;乙酸乙酯;乙酸钠;
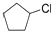
Ⅱ:环戊烷在氯气在光照条件下发生取代反应生成氯环戊烷( ),氯环戊烷(
),氯环戊烷( )能水解生成环戊醇,环戊醇能氧化生成环戊酮,方程式为:
)能水解生成环戊醇,环戊醇能氧化生成环戊酮,方程式为: ;
;
故答案为:(1)光照  ;(2)
;(2) ;
;
Ⅲ:①分子中含有2个羧基,可与乙醇发生酯化反应,完全酯化,与CH3CH2OH按物质的量比1:2反应的方程式为2CH3CH2OH+HOOC-CHOH-CH2COOH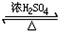 CH3CH2OOC-CHOH-CH2COOCH2CH3+2H2O,
CH3CH2OOC-CHOH-CH2COOCH2CH3+2H2O,
故答案为:2CH3CH2OH+HOOC-CHOH-CH2COOH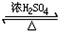 CH3CH2OOC-CHOH-CH2COOCH2CH3+2H2O.
CH3CH2OOC-CHOH-CH2COOCH2CH3+2H2O.
②分子中含有2个羧基,具有酸性,可与碳酸钠反应,和过量的Na2CO3溶液反应反应的方程式为HOOC-CH(OH)-CH2-COOH+2Na2CO3→NaOOC-CH(OH)-CH2-COONa+2NaHCO3,
故答案为:HOOC-CH(OH)-CH2-COOH+2Na2CO3→NaOOC-CH(OH)-CH2-COONa+2NaHCO3.
点评 本题考查乙酸乙酯的制备、物质的分离与提纯等知识,题目难度中等,注意掌握酯化反应的制备装置及反应原理,明确分离混合物的操作步骤及实验评价的方法,(Ⅲ)②为易错点,注意明确反应物量的关系不同,产物不同.

| A. | 乙醇能燃烧 | |
| B. | 1molCH3CH2OH与Na完全反应只生成0.5molH2 | |
| C. | 乙醇分子中含有一个氧原子 | |
| D. | 乙醇能溶于水 |
| A. | 水中 | B. | 乙酸中 | C. | 煤油中 | D. | 乙醇中 |
| A. | 离子键就是阴阳离子间强烈的静电作用 | |
| B. | H和Cl形成的分子中存在的是极性共价键 | |
| C. | 氯化铵中没有金属元素,所以不是离子化合物 | |
| D. | 11号与9号元素能够形成离子化合物,该化合物中存在离子键 |
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M4均为直线形的共价化合物 | |
| C. | W2Z2是既含离子键又含共价键的离子化合物 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键、又有共价键 |
| A. | 只含有C、H两种元素 | |
| B. | 只含有C、O两种元素 | |
| C. | 含有C、H、O三种元素 | |
| D. | 一定含有C、H两种元素,不能确定是否含有O元素 |
| A. | 若溶液呈中性,则c(K+)=c(CH3COO-) | |
| B. | 若溶液呈碱性,则c(K+)>c(CH3COO-) | |
| C. | 若溶液呈酸性,则c(H+)>c(CH3COO-)>c(K+) | |
| D. | 溶液呈电中性,则c(H+)+c(K+)=c(CH3COO-)+c(OH-) |

 ;写出E与G反应生成H的结构简式是
;写出E与G反应生成H的结构简式是 .
.