题目内容
2.某有机物2.3g完全燃烧后,生成4.4g二氧化碳和2.7g水,则该有机物中( )| A. | 只含有C、H两种元素 | |
| B. | 只含有C、O两种元素 | |
| C. | 含有C、H、O三种元素 | |
| D. | 一定含有C、H两种元素,不能确定是否含有O元素 |
分析 n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,以此计算m(C)、m(H)的质量,结合质量守恒定律解答该题.
解答 解:n(CO2)=$\frac{4.4g}{44g/mol}$=0.1moL,n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,
则m(C)=0.1mol×12g/mol=1.2g,m(H)=0.15mol×2×1g/mol=0.3g,
1.2g+0.3g=1.5g<2.3g,
则含有C、H、O元素.
故选C.
点评 本题考查有机物的计算,侧重于学生的分析、计算能力的考查,注意从质量守恒的角度解答该题,难度不大.

练习册系列答案
相关题目
12.R、X、Y、Z、Q、W是六种原子序数依次增大的短周期元素,其相关信息如下表:
(1)Y的元素名称氮,它在元素周期表中位置是第2周期,第VA族;
(2)元素非金属性X比W弱(填“强”或“弱”); X和W的最高价氧化物对应的水化物中,酸性较强的是HClO4(写化学式)
(3)R与X形成的化合物中,分子中R、X原子个数比为1:1,且分子中只有一种环境的R原子,常温下呈液态,该物质的结构简式是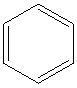 .R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.
.R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.
| 元素 | 相 关 信 息 |
| R | R在周期表中的周期数、族序数与其原子序数均相等 |
| X | X原子形成的化合物种类最多 |
| Y | Y的氢化物与其最高价氧化物的水化物化合生成一种盐 |
| Z | Z原子的最外层电子数为K层电子数的3倍 |
| Q | Q存在质量数为23,中子数为12的核素 |
| w | W在所处周期中原子半径最小 |
(2)元素非金属性X比W弱(填“强”或“弱”); X和W的最高价氧化物对应的水化物中,酸性较强的是HClO4(写化学式)
(3)R与X形成的化合物中,分子中R、X原子个数比为1:1,且分子中只有一种环境的R原子,常温下呈液态,该物质的结构简式是
 .R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.
.R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.
17.下列关于化学反应速率及化学反应限度的说法正确的是( )
| A. | 当一个化学反应达到一定反应限度时,该反应就停止了 | |
| B. | 化学反应速率为“0.8mol•L-1•s-1”表示的意思是:时间为1s时,某物质的浓度为0.8mol•L-1 | |
| C. | 根据化学反应速率的大小可以知道化学反应进行的限度 | |
| D. | 对于不同的化学反应而言,化学反应速率大的不一定反应就快 |
7.下列每组中各有三对物质,它们都能用分液漏斗分离的是( )
| A. | 甘油和水、乙醛和水、乙酸和乙醇 | |
| B. | 油酸和水、甲苯和水、己烷和苯 | |
| C. | 乙酸乙酯和水、酒精和水、苯酚和水 | |
| D. | 二溴乙烷和水、溴苯和水、硝基苯和水 |
11.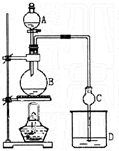 某课外小组设计的实验室制取乙酸乙酯的装置如图所示. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点如下表:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点如下表:
A中放醋酸,B中将过量的乙醇与少量浓硫酸混合,D中放有饱和碳酸钠溶液.经分液漏斗边滴加醋酸、边加热.
请回答:
(1)反应中加入的乙醇是过量的,其目的是增加一种反应物,有利于酯化反应正向进行;
(2)该反应中,若用CH3CH218OH与乙酸发生反应,则反应的化学方程式为CH3COOH+CH3CH218OH CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.
(3)球形干燥管C的作用是冷凝、防倒吸.
若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是溶液分层,上层为无色油状液体,下层溶液颜色由红色变为无色(或变浅).
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;再加入(此空从下列选项中选择)C,
目的是除水,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.
A.五氧化二磷B.碱石灰C.无水硫酸钠D.生石灰.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点如下表:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点如下表:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)反应中加入的乙醇是过量的,其目的是增加一种反应物,有利于酯化反应正向进行;
(2)该反应中,若用CH3CH218OH与乙酸发生反应,则反应的化学方程式为CH3COOH+CH3CH218OH
 CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.(3)球形干燥管C的作用是冷凝、防倒吸.
若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是溶液分层,上层为无色油状液体,下层溶液颜色由红色变为无色(或变浅).
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;再加入(此空从下列选项中选择)C,
目的是除水,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.
A.五氧化二磷B.碱石灰C.无水硫酸钠D.生石灰.
19.“类推”是一种常用的学习方法,但有时会产生错误的结论,下列类推结论中正确的是( )
| A. | IVA族元素氢化物熔点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物熔点顺序也是:AsH3>PH3>NH3 | |
| B. | 第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| C. | 工业上用电解氯化镁制备镁单质,工业上也可用电解氯化铝制备铝单质 | |
| D. | Fe3O4可改写成氧化物的形式为:FeO•Fe2O3;因此Pb3O4也可改写为:PbO•Pb2O3 |
 $\stackrel{反应1}{→}$X$\stackrel{反应2}{→}$Y$\stackrel{反应3}{→}$
$\stackrel{反应1}{→}$X$\stackrel{反应2}{→}$Y$\stackrel{反应3}{→}$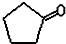
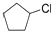
 .
.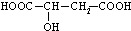
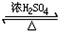 CH3CH2OOC-CHOH-CH2COOCH2CH3+2H2O
CH3CH2OOC-CHOH-CH2COOCH2CH3+2H2O CH3COOC2H5+H2O.其中浓H2SO4的作用是催化剂和吸水剂
CH3COOC2H5+H2O.其中浓H2SO4的作用是催化剂和吸水剂