题目内容
1.下列有关化学键和化合物的说法不正确的是( )| A. | 离子键就是阴阳离子间强烈的静电作用 | |
| B. | H和Cl形成的分子中存在的是极性共价键 | |
| C. | 氯化铵中没有金属元素,所以不是离子化合物 | |
| D. | 11号与9号元素能够形成离子化合物,该化合物中存在离子键 |
分析 A.离子键为离子的静电作用力;
B、H和Cl是两种不同的原子形成的共价键;
C、氯化铵是铵根离子和氯离子形成的离子化合物;
D、钠与氟可形成氟化钠是离子化合物.
解答 解:A.离子键为离子的静电作用力,既有引力也有斥力,故A正确;
B、H和Cl是两种不同的原子形成的共价键,所以是极性共价键,故B正确;
C、氯化铵是铵根离子和氯离子形成的离子化合物,故C错误;
D、钠与氟可形成氟化钠是离子化合物,故D正确;
故选C.
点评 本题考查化学键,为高频考点,把握化学键判断的一般规律为解答的关键,注重基础知识的考查,选项D为解答的易错点,题目难度不大.

练习册系列答案
相关题目
11.同一周期的4种元素,原子半径从小到大的顺序为C<A<D<B(不包括稀有气体元素),则最有可能形成共价化合物的是( )
| A. | C与A | B. | C与D | C. | D与B | D. | B与C |
12.R、X、Y、Z、Q、W是六种原子序数依次增大的短周期元素,其相关信息如下表:
(1)Y的元素名称氮,它在元素周期表中位置是第2周期,第VA族;
(2)元素非金属性X比W弱(填“强”或“弱”); X和W的最高价氧化物对应的水化物中,酸性较强的是HClO4(写化学式)
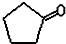
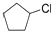
(3)R与X形成的化合物中,分子中R、X原子个数比为1:1,且分子中只有一种环境的R原子,常温下呈液态,该物质的结构简式是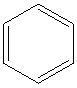 .R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.
.R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.
| 元素 | 相 关 信 息 |
| R | R在周期表中的周期数、族序数与其原子序数均相等 |
| X | X原子形成的化合物种类最多 |
| Y | Y的氢化物与其最高价氧化物的水化物化合生成一种盐 |
| Z | Z原子的最外层电子数为K层电子数的3倍 |
| Q | Q存在质量数为23,中子数为12的核素 |
| w | W在所处周期中原子半径最小 |
(2)元素非金属性X比W弱(填“强”或“弱”); X和W的最高价氧化物对应的水化物中,酸性较强的是HClO4(写化学式)
(3)R与X形成的化合物中,分子中R、X原子个数比为1:1,且分子中只有一种环境的R原子,常温下呈液态,该物质的结构简式是
 .R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.
.R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.
16.下列有关纤维素的叙述正确的是( )
| A. | 纤维素在稀硫酸、加热的条件下水解 | |
| B. | 棉制品吸湿性好和分子中具有-OH有关 | |
| C. | 纤维指的就是纤维素 | |
| D. | 纤维素因分子结构中含-OH,可和浓HNO3发生硝化反应 |
6.使用一种试剂就能鉴别出来的是( )
| A. | 苯、甲苯、己烯 | B. | 甲苯、己烯、四氯化碳 | ||
| C. | 己烯、汽油、苯 | D. | 苯、甲苯、二甲苯 |
11.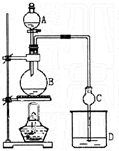 某课外小组设计的实验室制取乙酸乙酯的装置如图所示. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点如下表:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点如下表:
A中放醋酸,B中将过量的乙醇与少量浓硫酸混合,D中放有饱和碳酸钠溶液.经分液漏斗边滴加醋酸、边加热.
请回答:
(1)反应中加入的乙醇是过量的,其目的是增加一种反应物,有利于酯化反应正向进行;
(2)该反应中,若用CH3CH218OH与乙酸发生反应,则反应的化学方程式为CH3COOH+CH3CH218OH CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.
(3)球形干燥管C的作用是冷凝、防倒吸.
若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是溶液分层,上层为无色油状液体,下层溶液颜色由红色变为无色(或变浅).
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;再加入(此空从下列选项中选择)C,
目的是除水,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.
A.五氧化二磷B.碱石灰C.无水硫酸钠D.生石灰.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点如下表:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点如下表:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)反应中加入的乙醇是过量的,其目的是增加一种反应物,有利于酯化反应正向进行;
(2)该反应中,若用CH3CH218OH与乙酸发生反应,则反应的化学方程式为CH3COOH+CH3CH218OH
 CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.(3)球形干燥管C的作用是冷凝、防倒吸.
若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是溶液分层,上层为无色油状液体,下层溶液颜色由红色变为无色(或变浅).
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;再加入(此空从下列选项中选择)C,
目的是除水,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.
A.五氧化二磷B.碱石灰C.无水硫酸钠D.生石灰.
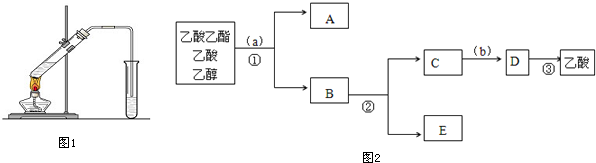

 .
.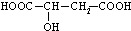
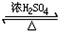 CH3CH2OOC-CHOH-CH2COOCH2CH3+2H2O
CH3CH2OOC-CHOH-CH2COOCH2CH3+2H2O CH3COOC2H5+H2O.其中浓H2SO4的作用是催化剂和吸水剂
CH3COOC2H5+H2O.其中浓H2SO4的作用是催化剂和吸水剂