题目内容
(15分)工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。
(1)火箭常用N2H4作燃料,N2O4作氧化剂。已知:
N2(g) + 2O2(g)=2NO2(g) △H = +67.7 kJ·mol-1
N2H4(g) + O2(g)=N2(g) + 2H2O(g) △H =-534.0 kJ·mol-1
NO2(g) 1/2N2O4(g) △H =-26.35 kJ·mol-1
1/2N2O4(g) △H =-26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: 。
(2)联氨——空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液。该电池放电时,正极的电极反应式为 。
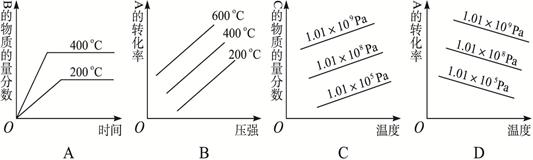
(3)在300℃时,改变起始反应物中氢气的物质的量对反应N2(g) + 3H2(g) 2NH3(g) △H<0的影响如图所示。
2NH3(g) △H<0的影响如图所示。

①请在图中画出400℃时对应的图像。
②在a、b、c三点中,H2 的转化率最高的是 (填字母)。
(4)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2 NO+NO2+Na2CO3=2NaNO2+CO2
若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1.0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
(1)火箭常用N2H4作燃料,N2O4作氧化剂。已知:
N2(g) + 2O2(g)=2NO2(g) △H = +67.7 kJ·mol-1
N2H4(g) + O2(g)=N2(g) + 2H2O(g) △H =-534.0 kJ·mol-1
NO2(g)
 1/2N2O4(g) △H =-26.35 kJ·mol-1
1/2N2O4(g) △H =-26.35 kJ·mol-1试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: 。
(2)联氨——空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液。该电池放电时,正极的电极反应式为 。
(3)在300℃时,改变起始反应物中氢气的物质的量对反应N2(g) + 3H2(g)
 2NH3(g) △H<0的影响如图所示。
2NH3(g) △H<0的影响如图所示。
①请在图中画出400℃时对应的图像。
②在a、b、c三点中,H2 的转化率最高的是 (填字母)。
(4)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2 NO+NO2+Na2CO3=2NaNO2+CO2
若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1.0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
(共15分)
(1)2N2H4(g) + N2O4 (g)=3N2(g) + 4H2O(g) △H = -1083.0 kJ·mol-1(3分)
(2)O2 + 4e-+ 2H2O=4OH-(2分)
(3)① (2分) ② a(2分)
(2分) ② a(2分)
(4)30%(6分)
(1)2N2H4(g) + N2O4 (g)=3N2(g) + 4H2O(g) △H = -1083.0 kJ·mol-1(3分)
(2)O2 + 4e-+ 2H2O=4OH-(2分)
(3)①
 (2分) ② a(2分)
(2分) ② a(2分)(4)30%(6分)
(1)根据盖斯定律可知②×2-(①+③×2),即得到反应2N2H4(g) + N2O4 (g)=3N2(g) + 4H2O(g),所以该反应的反应热△H =-534.0 kJ·mol-1×2-67.7 kJ·mol-1+26.35kJ·mol-1×2=-1083.0 kJ·mol-1。
(2)原电池中负极失去电子,正极得到电子,所以正极是氧气得到电子。由于电解质是氢氧化钾,所以正极电极反应式是O2 + 4e-+ 2H2O=4OH-。
(3)①升高温度。反应速率增大,到达平衡的时间减少。但由于正反应是放热反应,所以升高温度,氨气的含量是降低的,因此图像是 。
。
②增大氢气的浓度,平衡向正反应方向移动,但氢气的转化率是降低的,所以图像中转化率最高的应该是a点。
(4)由反应的转化关系式可知,反应过程中钠原子是守恒的,所以如果设NaNO2和和NaNO3的物质的量分别为4a mol和a mol,则4a+a=50mL×10-3mL?L-1×1.0 mol?L-1×2,解得:a=0.02 mol,所以NO、NO2的物质的量分别是:0.03 mol、0.07 mol,因此NO所占的体积分数为30%。
(2)原电池中负极失去电子,正极得到电子,所以正极是氧气得到电子。由于电解质是氢氧化钾,所以正极电极反应式是O2 + 4e-+ 2H2O=4OH-。
(3)①升高温度。反应速率增大,到达平衡的时间减少。但由于正反应是放热反应,所以升高温度,氨气的含量是降低的,因此图像是
 。
。②增大氢气的浓度,平衡向正反应方向移动,但氢气的转化率是降低的,所以图像中转化率最高的应该是a点。
(4)由反应的转化关系式可知,反应过程中钠原子是守恒的,所以如果设NaNO2和和NaNO3的物质的量分别为4a mol和a mol,则4a+a=50mL×10-3mL?L-1×1.0 mol?L-1×2,解得:a=0.02 mol,所以NO、NO2的物质的量分别是:0.03 mol、0.07 mol,因此NO所占的体积分数为30%。

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
 2SO3反应,增大压强,平衡会正向移动,
2SO3反应,增大压强,平衡会正向移动,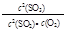 的值增大
的值增大 H2+I2
H2+I2
 H2O(l) 的ΔH =" 40.69" kJ·mol-1
H2O(l) 的ΔH =" 40.69" kJ·mol-1
 的ΔH为-384 kJ·mol-1
的ΔH为-384 kJ·mol-1 PCl5(g) ΔH= -93kJ?mol—1 ,达平衡时放热139.5kJ,则PCl3的转化率为75%
PCl5(g) ΔH= -93kJ?mol—1 ,达平衡时放热139.5kJ,则PCl3的转化率为75%
 2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变 2C(g)+Q (Q>0),下列图象正确的是 ?
2C(g)+Q (Q>0),下列图象正确的是 ?