题目内容
8.某未知溶液可能含Na+、NH4+、Fe2+、I-、Cl-、CO32-、SO32-.将该溶液加少量新制氯水,溶液变黄色.再向上述反应后溶液中加入BaCl2溶液或淀粉溶液,均无明显现象.下列推断合理的是( )| A. | 一定存在Fe2+、Na+、Cl- | B. | 一定不存在I-、SO32- | ||
| C. | 一定呈碱性 | D. | 一定存在NH4+ |
分析 将该溶液加少量新制氯水,溶液变黄色,溶液中可能存在Fe2+、I-,再向上述反应后溶液中加入BaCl2溶液或淀粉溶液,均无明显现象,则说明溶液中不存在SO32-、I-,则一定存在Fe2+;根据离子共存可知,溶液中一定不存在CO32-;结合溶液电中性可知,溶液中一定存在Cl-,可能存在Na+、NH4+,据此进行解答.
解答 解:将该溶液加少量新制氯水,溶液变黄色,溶液中可能存在Fe2+、I-,再向上述反应后溶液中加入BaCl2溶液或淀粉溶液,均无明显现象,则说明溶液中不存在SO32-、I-,则一定存在Fe2+;根据离子共存可知,溶液中一定不存在CO32-;结合溶液电中性可知,溶液中一定存在Cl-,可能存在Na+、NH4+,
根据分析可知,溶液中一定存在的离子为:Fe2+、Cl-,一定不存在的离子为:I-、CO32-、SO32-,可能存在Na+、NH4+,
A.溶液中一定存在Fe2+、Cl-,无法确定是否存在Na+,故A错误;
B.溶液中一定不存在一定不存在I-、SO32-,故B正确;
C.溶液中存在亚铁离子,亚铁离子水解,溶液显示酸性,故C错误;
D.溶液中不一定存在铵根离子,故D错误;
故选B.
点评 本题考查了常见离子的检验,题目难度中等,明确常见离子的性质及检验方法为解答关键,试题侧重考查显示的分析、理解能力,根据电中性判断氯离子的存在情况为易错点.

练习册系列答案
相关题目
19.实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间判断空气中的含汞量,其反应为:4CuI+Hg=Cu2Hgl4+2Cu2,下列说法正确的是( )
| A. | 产物Cu2HgI4中,Cu元素的化合价为+2 | |
| B. | 由Cu2+与I-直接反应制得CuI的离子方程式为Cu2++I-=CuI | |
| C. | 该反应的氧化剂CuI,氧化产物为Cu | |
| D. | 当有2molCuI参与反应时,转移电子为1mol |
3.2015年2月,科学家首次观测到化学键的形成.化学键不存在于( )
| A. | 原子与原子之间 | B. | 分子与分子之间 | C. | 离子与离子之间 | D. | 离子与电子之间 |
13.向含1mol NaOH、2mol NaAl(OH)4、1mol Ba(OH)2的混合液中加入稀硫酸充分反应,加入溶质H2SO4的量和生成沉淀的量的关系正确的是( )
| 选项 | A | B | C | D |
| n(H2SO4)/mol | 2 | 3 | 4 | 5 |
| n(沉淀)/mol | 2 | 3 | 2 | 1.5 |
| A. | A | B. | B | C. | C | D. | D |
14.下表是元素周期表的一部分,完成下列有关问题:
(1)在这些元素中,最活泼的金属元素是K(填元素符号或化学式,下同),最活泼的非金属元素是F,最不活泼的元素是Ar.
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(3)在这些元素中,原子半径最小的是F,原子半径最大的是K.
(4)在③和④中,化学性质较活泼的是Na,怎样用化学实验证明?答:与H2O反应.在⑧与⑫中,化学性质较活泼的是Cl,怎样用化学实验证明?答:单质间的置换反应(氯气能置换出NaBr中的Br生成溴单质).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(3)在这些元素中,原子半径最小的是F,原子半径最大的是K.
(4)在③和④中,化学性质较活泼的是Na,怎样用化学实验证明?答:与H2O反应.在⑧与⑫中,化学性质较活泼的是Cl,怎样用化学实验证明?答:单质间的置换反应(氯气能置换出NaBr中的Br生成溴单质).
 .
.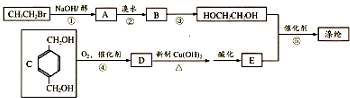
 ,反应①、②的反应类型分别为消去反应、加成反应,有机物B的名称是1,2-二溴乙烷,反应③可用的试剂为氢氧化钠水溶液;
,反应①、②的反应类型分别为消去反应、加成反应,有机物B的名称是1,2-二溴乙烷,反应③可用的试剂为氢氧化钠水溶液;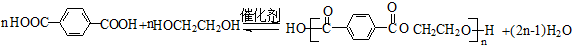 ;
;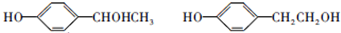 ;
;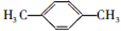 ;F的一种同系物G比F多2个碳原子,其中苯环上只有一个取代基的G的结构有4种.
;F的一种同系物G比F多2个碳原子,其中苯环上只有一个取代基的G的结构有4种.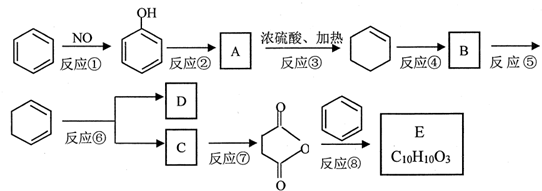
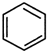 +(CH3CO)2O→
+(CH3CO)2O→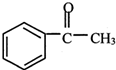 +CH3COOH
+CH3COOH ; B
; B
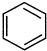 直接制取
直接制取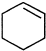 ,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.
,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.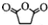 +
+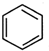 →
→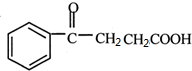 .
.

 也可发生类似反应①的反应,生成化合物Ⅳ:
也可发生类似反应①的反应,生成化合物Ⅳ: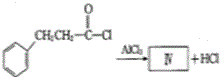
 .
. .
. .
.