题目内容
16.下列有关实验的说法不正确的是( )| A. | 在测定中和反应的反应热实验中,要读取最高温度 | |
| B. | 中和滴定实验中,洗净后的锥形瓶不需要干燥 | |
| C. | 向CH3COONa溶液中滴入石蕊试液,溶液变蓝 | |
| D. | 向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS) |
分析 A.最高温度为恰好完全反应的温度;
B.中和滴定实验中,洗净后的锥形瓶不需要干燥,不影响实验结果;
C.醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性;
D.溶度积常数大的难溶物能向溶度积常数小的难溶物转化.
解答 解:A.最高温度为恰好完全反应的温度,利用初始温度与最高温度可计算中和热,故A正确;
B.中和滴定实验中,洗净后的锥形瓶不需要干燥,不干燥只改变待测液浓度而不改变待测液中溶质的物质的量,所以不影响实验结果,故B正确;
C.醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,紫色石蕊试液遇碱变蓝色,故C正确;
D.溶度积常数大的难溶物能向溶度积常数小的难溶物转化,向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)>Ksp(CuS),故D错误;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及中和滴定、盐类水解、难溶物转化等知识点,明确实验原理及物质性质是解本题关键,易错选项是B,注意从操作规范性及物质性质方面解答,题目难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
1.在前一种分散系中慢慢地滴入后一种溶液所观察到的现象不是先沉淀后变澄清的是( )
| A. | 氢氧化铁胶体滴加盐酸 | B. | 四羟基合铝酸钠溶液中加盐酸 | ||
| C. | 氯化铝溶液中滴加氢氧化钠溶液 | D. | 氯化铝溶液中滴加氨水 |
8.将amol纯铁粉投入含HNO3bmol的稀溶液里,恰好完全反应并放出NO气体,则a和b的关系是( )
| A. | $\frac{a}{b}$=$\frac{1}{4}$ | B. | $\frac{a}{b}$=$\frac{3}{8}$ | C. | $\frac{1}{4}$≤$\frac{a}{b}$≤$\frac{3}{8}$ | D. | $\frac{a}{b}$的值无法确定 |
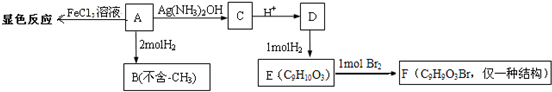
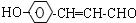 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O,反应类型为氧化反应
+2Ag↓+3NH3+H2O,反应类型为氧化反应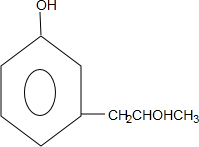 ,G的结构简式
,G的结构简式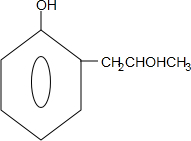 .
.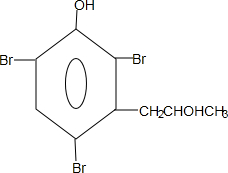 能够溶于有机物,不溶于水,所以在NaOH溶液中出现白色沉淀
能够溶于有机物,不溶于水,所以在NaOH溶液中出现白色沉淀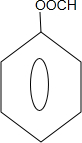 ,
,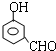 或
或 或
或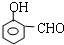 .
.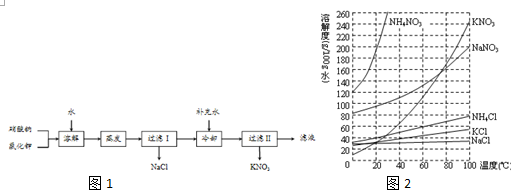

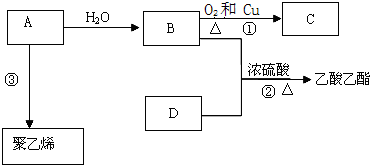
 .
.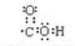 ;
; 反应类型:加聚反应.
反应类型:加聚反应.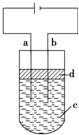 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色、纯净的Fe(OH)2沉淀,应用如图所示电解实验可制得白色、纯净的Fe(OH)2沉淀,两电极的材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色、纯净的Fe(OH)2沉淀,应用如图所示电解实验可制得白色、纯净的Fe(OH)2沉淀,两电极的材料分别为石墨和铁.