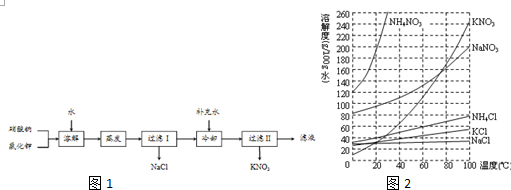
题目内容
8.将2.24升(标况)CO2通入25毫升4mol/L KOH溶液中使之完全反应,该变化的化学方程式为CO2+KOH═KHCO3;再向此溶液中加入少量澄清石灰水,可观察的现象为有白色沉淀产生,发生此变化的离子方程式为Ca2++2OH-+2HCO3-═CO32-+2H2O+CaCO3↓.分析 根据n=$\frac{V}{{V}_{m}}$计算二氧化碳的物质的量,二氧化碳和氢氧化钾反应:CO2+KOH=KHCO3,CO2+2KOH=K2CO3+H2O,结合二氧化碳和氢氧化钾两者的物质的量的关系进行分析解答,根据二氧化碳和氢氧化钾反应的产物和加入少量澄清石灰水发生的反应分析观察的现象,据此书写离子反应方程式.
解答 解:2.24L(标况下)CO2气体的物质的量n=$\frac{V}{{V}_{m}}$=$\frac{2.24L}{22.4L/mol}$=0.1mol,25毫升4mol/L KOH溶液n=cv=4mol/L×0.025L=0.1mol,n(CO2):n(KOH)=1:1,所以二氧化碳和氢氧化钾反应:CO2+KOH=KHCO3,二氧化碳和氢氧化钾反应的产物为碳酸氢钾,碳酸氢钾和少量氢氧化钙反应,碳酸氢根离子和氢氧根离子反应生成碳酸根离子和钙离子反应生成碳酸钙沉淀,所以有白色沉淀生成,再向此溶液中加入少量澄清石灰水,氢氧化钙电离出的氢氧根离子全部反应,所以反应为:Ca2++2OH-+2HCO3-═CO32-+2H2O+CaCO3↓,
故答案为:CO2+KOH═KHCO3;有白色沉淀产生;Ca2++2OH-+2HCO3-═CO32-+2H2O+CaCO3↓.
点评 本题考查了方程式的书写,注意二氧化碳和氢氧化钾反应量的关系是解答的关键,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
18.在0.1mol/L(NH4)2SO4溶液中,离子浓度最大的是( )
| A. | SO42- | B. | NH4+ | C. | H+ | D. | OH- |
19.下列广告语中,你认为符合科学道理的是( )
| A. | “超纯水”、“超纯蒸馏水”绝对卫生,对人体有益 | |
| B. | 含碘食盐可防治甲状腺肿大,但也不能滥补,造成体内碘含量过高 | |
| C. | 本饮料由纯天然物质配置而成,绝对不含化学物质,对人体无害 | |
| D. | 含氟牙膏可适合任何人群预防龋齿 |
16.下列关于化学键和化合物的说法中正确的是( )
| A. | 化学键的形成一定伴随着电子的得失 | |
| B. | 金属元素和非金属元素形成的化合物一定是离子化合物 | |
| C. | 含有阴离子的化合物一定含有阳离子 | |
| D. | 非金属元素组成的化合物一定是共价化合物 |
3.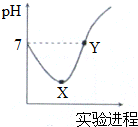 常温下,将Cl2缓慢通入一定量的蒸馏水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的NaOH溶液,整个过程中pH变化如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入一定量的蒸馏水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的NaOH溶液,整个过程中pH变化如图所示,下列叙述正确的是( )
 常温下,将Cl2缓慢通入一定量的蒸馏水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的NaOH溶液,整个过程中pH变化如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入一定量的蒸馏水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的NaOH溶液,整个过程中pH变化如图所示,下列叙述正确的是( )| A. | X、Y两点所示溶液中含有微粒的种类前者多 | |
| B. | X、Y两点所示溶液中水的电离程度前者大 | |
| C. | Y点所示溶液中存在c(Na+)=c(HClO)+2c(ClO-) | |
| D. | X点所示溶液中发生反应的离子方程式为Cl2+H2O═2 H++Cl-+ClO- |
13.蛋白质发生的下列反应中,可逆的是( )
| A. | 盐析 | B. | 变性 | C. | 煮熟 | D. | 加入硫酸钠 |
20.下列关于氯气的叙述中正确的是( )
| A. | 氯气是一种黄绿色、有毒的气体 | |
| B. | 氯气的密度比空气的小 | |
| C. | 氯气不能溶于水,可以用排水法收集 | |
| D. | 氯气、氯水和液氯是同一种物质 |

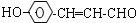 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$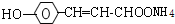 +2Ag↓+3NH3+H2O,反应类型为氧化反应
+2Ag↓+3NH3+H2O,反应类型为氧化反应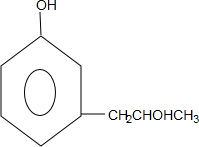 ,G的结构简式
,G的结构简式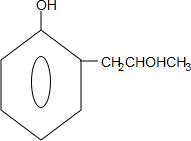 .
.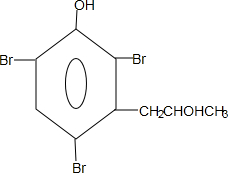 能够溶于有机物,不溶于水,所以在NaOH溶液中出现白色沉淀
能够溶于有机物,不溶于水,所以在NaOH溶液中出现白色沉淀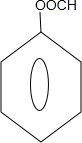 ,
,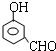 或
或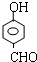 或
或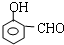 .
.